六氟化铂
外观
| 六氟化铂 | |
|---|---|
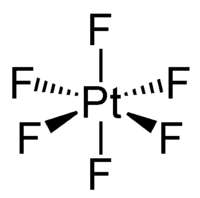
| |
| IUPAC名 Platinum hexafluoride | |
| 别名 | 氟化铂(VI) |
| 识别 | |
| CAS号 | 13693-05-5 |
| PubChem | 22238670 |
| ChemSpider | 2283064 |
| SMILES |
|
| InChI |
|
| EINECS | 237-214-0 |
| 性质 | |
| 化学式 | PtF6 |
| 摩尔质量 | 309.1 g·mol⁻¹ |
| 外观 | 暗红色易挥发性的固体[1] 蒸气为类似溴的红棕色[2] |
| 密度 | 5.21 g/cm3(计算)[3] 3.826 g/cm3(液态,64.3 °C)[2] |
| 熔点 | 61.3 °C[1] |
| 沸点 | 69.1 °C[1] |
| 溶解性(水) | 水解[2] |
| 结构[3] | |
| 晶体结构 | 正交晶系 |
| 空间群 | Pnma (No. 62) |
| 晶格常数 | a = 937.4 pm, b = 852.7 pm, c = 493.3 pm |
| 危险性 | |
| 主要危害 | 氧化性 |
| 相关物质 | |
| 相关化学品 | 六氟合铂酸氙 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
六氟化铂,又称氟化铂(VI),化学式为PtF6。它是一个深红色的挥发性固体,气态时则变成红棕色。该化合物中铂的氧化态为+6,只有四个d电子,呈顺磁性,基态时为三线态。PtF6是很强的氧化剂和氟化剂,甚至可以氧化氙,造就第一个惰性气体化合物六氟合铂酸氙的发现。
合成
[编辑]PtF6首次由金属铂与氟气化合制备,[4]此反应至今仍是首选方法。[3]
- Pt + 3 F2 → PtF6
此外,六氟化铂也可由PtF5在130 °C下歧化得到,[5]而反应物PtF5可由氟化PtCl2制得。[6]
- 2 PtCl2 + 5 F2 → 2 PtF5 + 2 Cl2
- 2 PtF5 → PtF6 + PtF4
性质
[编辑]六氟化铂是暗红色晶体,[1]蒸汽则呈红棕色,在200 °C下仍然稳定。[5]固态和气态六氟化铂都为八面体构型,Pt-F键长为185 pm。[3]
反应
[编辑]PtF6是强氧化剂,甚至可以和氙反应,生成六氟合铂酸氙(XePtF6)。1962年发现的此反应证明了稀有气体也能形成化合物。[7]此外,PtF6也可以氧化氧气,生成含有二氧基(O2+)的化合物六氟合铂酸氧(O2PtF6)。[8]它剧烈水解,生成[PtF6]2-,并放出氧气。[9]
PtF6能和三氟化溴、四氟化镎、四氟化钚反应,分别生成五氟化溴、六氟化镎、六氟化钚。[2]它还能和亚硝酰氟、硝酰氟、四氧化二氮反应,分别生成NOPtF6、NO2PtF6、N2O3PtF6。[10]PtF6也会和一氧化氮反应,产生NOPtF6,但无法和一氧化二氮反应。[10]
它和氯酰氟[11]或五氟化氯[12]反应,生成六氟合氯(VII)𬭩盐。它和氟化铯在氟化氢里反应,生成CsPtF6,并放出氟气。[13]
参考资料
[编辑]- ^ 1.0 1.1 1.2 1.3 Lide, David R. (编). CRC Handbook of Chemistry and Physics 90th. Boca Raton, Florida: CRC Press. 2009: 4–81. ISBN 978-1-4200-9084-0 (英语).
- ^ 2.0 2.1 2.2 2.3 Weinstock, Bernard; Malm, John G.; Weaver, E. Eugene. The Preparation and Some Properties of Platinum Hexafluoride. Journal of the American Chemical Society (American Chemical Society (ACS)). 1961, 83 (21): 4310–4317. ISSN 0002-7863. doi:10.1021/ja01482a002.
- ^ 3.0 3.1 3.2 3.3 Drews, Thomas; Supeł, Joanna; Hagenbach, Adelheid; Seppelt, Konrad. Solid State Molecular Structures of Transition Metal Hexafluorides. Inorganic Chemistry (American Chemical Society (ACS)). 2006-03-28, 45 (9): 3782–3788. ISSN 0020-1669. doi:10.1021/ic052029f.
- ^ Weinstock, Bernard; Claassen, Howard H.; Malm, John G. Platinum Hexafluoride. Journal of the American Chemical Society (American Chemical Society (ACS)). 1957, 79 (21): 5832–5832. ISSN 0002-7863. doi:10.1021/ja01578a073.
- ^ 5.0 5.1 Brauer, Georg. Handbuch der präparativen anorganischen Chemie. Stuttgart: Enke. 1975: 278. ISBN 3-432-02328-6 (德语).
- ^ Bartlett, N.; Lohmann, D. H. Two New Fluorides of Platinum. Proceedings of the Chemical Society (London). 1960: 14–15. doi:10.1039/PS9600000001.
- ^ Proceedings of the Chemical Society. June 1962. Proceedings of the Chemical Society (Royal Society of Chemistry (RSC)). 1962, (June): 218. ISSN 0369-8718. doi:10.1039/ps9620000197.
- ^ Bartlett, Neil; Lohmann, D. H. Fluorides of the Noble Metals. Part II. Dioxygenyl hexafluoroplatinate(V), [O
2]+
[PtF
6]−
.. J. Chem. Soc. 1962, 115: 5253–5261. doi:10.1039/jr9620005253. - ^ Gulliver, D.J.; Levason, W. The chemistry of ruthenium, osmium, rhodium, iridium, palladium and platinum in the higher oxidation states. Coordination Chemistry Reviews (Elsevier BV). 1982, 46: 1–127. ISSN 0010-8545. doi:10.1016/0010-8545(82)85001-7.
- ^ 10.0 10.1 Gortsema, F. P.; Toeniskoetter, R. H. The Chemistry of Platinum Hexafluoride. I. Reactions with Nitric Oxide, Dinitrogen Tetroxide, Nitrosyl Fluoride, and Nitryl Fluoride. Inorganic Chemistry (American Chemical Society (ACS)). 1966, 5 (7): 1217–1222. ISSN 0020-1669. doi:10.1021/ic50041a031.
- ^ Christe, Karl O. The hexafluorochlorine (VII) cation, CIF6+. Inorganic and Nuclear Chemistry Letters. 1972, 8 (8): 741–745. ISSN 0020-1650. doi:10.1016/0020-1650(72)80129-6.
- ^ US 3709748A,「Ionic interhalogen oxidizing agent and method」
- ^ Mazej, Z.; Goreshnik, E.; Christe, K.O. Photochemical preparation of Cs[MF6] salts (M = Ru, Rh, Os, Ir, Pt); crystal structures and Raman spectra. Journal of Fluorine Chemistry (Elsevier BV). 2023, 268: 110128. ISSN 0022-1139. doi:10.1016/j.jfluchem.2023.110128.
延伸阅读
[编辑]- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
