马尔科夫尼科夫规则
马尔科夫尼科夫规则(英語:Markovnikov's Rule / Markownikoff's Rule),又稱马氏规则,是有机化学中一个基于查依采夫规则的区域选择性经验规则,其内容即:当发生亲电加成反应(如卤化氢和烯烃的反应)时,亲电试剂中的正电基团(如氢)較傾向加在连氢最多(取代最少)的碳原子上,而负电基团(如卤素)则会加在连氢最少(取代最多)的碳原子上。[1]这个规则是由俄國化学家馬可尼可夫在1870年提出的。[2][3]
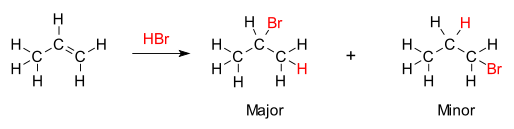
除烯烃、炔烃与水、卤素、卤化氢、次卤酸、酸、醇、酚加成的反应外,烯烃的羟汞化反应、烷氧汞化-去汞反应也是符合马尔科夫尼科夫规则的。
解釋
[编辑]马尔科夫尼科夫规则的原因是亲电加成反应中生成了较为稳定的碳正离子。加上一个H+的碳原子会使其他碳原子上引入一个正电荷,形成一个碳正离子。由于诱导效应和超共轭效应,取代基(碳上连接的碳或给电子基团)越多的碳正离子越稳定。而加成反应的主要产物会由一个更加稳定的中间体产生。所以烯烃加溴化氢时,溴化氢中的氢总是加在连氢最多的碳上,而卤素基团加在连氢最少的碳上。然而,其它比较不稳定的碳正离子仍然存在,通过它们生成的产物是不符合马尔科夫尼科夫规则的,通常是反应的副产物。
这个规则可以概括为“氢多加氢”、“富者愈富,而穷者愈穷”、化學中的馬太效應等等:连氢多的碳会得到另外的氢,而连氢少的碳会得到另外的取代基。对于其他不对称亲电试剂也是如此。正电基团加到取代少的碳上,负电基团加到取代多的碳上。
六十年后的認可
[编辑]马尔科夫尼科夫用于证明其规则的一个反应是碘化氢和溴乙烯的加成。根据他的规则,卤素原子将会加在已经有一个卤素的碳上。而这个产物(1-碘-1-溴乙烷)是偕卤化物水解反应的产物。用潮湿的氧化银处理这个产物则会得到乙醛,证明了产物的结构。

有人[3]认为,在1869年马尔科夫尼科夫的论文是粗心的,因为他自己没有做很多实验。这个规则仅仅作为了一个四页长的脚注出现在了一篇26页的文章中。因此他的规则经过了大约60年才被广泛认可。
反马尔科夫尼科夫规则
[编辑]很多反应的区域选择性性质都与马尔科夫尼科夫规则所做的预测相悖,这些反应称为反马尔科夫尼科夫规则的反应(Anti-Markovnikov reactions)。氢加到含氢较少的碳原子上,卤素等负电基团加成到了含氢较多的碳原子上。
反马尔科夫尼科夫规则的一个例子是吸电子基团取代的烯烃与亲电试剂的反应。受诱导效应影响,当烯烃双键碳上连有-CF3等吸电子基时,直接与这些基团相连的碳原子带有部分负电荷,它所形成的碳正离子是不稳定的。虽然亲电加成仍然符合电性规律,但是H+会加到靠近吸电子基的双键碳上,生成反马尔科夫尼科夫规则的产物。
硼氢化-氧化反应也是常见的反马尔科夫尼科夫规则反应之一。这个反应中硼原子是亲电性的(δ+),倾向于取代较少的双键碳结合,使该碳原子带有部分负电荷,将正电荷留给另外一个双键碳,(部分)形成较稳定的碳正离子。

反马尔科夫尼科夫规则的反应也包括不以碳正离子作为中间体的反应,比如烯烃和卤化氢的自由基加成反应。以HBr为例, 是链增长中与烯烃发生加成的试剂,而只有溴加到取代少的碳上时,才能形成较为稳定的自由基。自由基的稳定性与碳正离子类似,取代越多的自由基越稳定。形成的自由基从另一分子HBr夺取氢,反应的总体结果是氢加到了取代较多的碳原子上。
反马尔科夫尼科夫规则的性质也可以发生在炔烃的亲电加成反应上。比如苯乙炔和水的反应,在金的催化下,会得到苯乙酮,而在钌配合物的催化下,则会得到异构体苯乙醛[4]:

由于碳正离子会发生重排,故重排后生成的产物也往往不符合马尔科夫尼科夫规则。下图中单一构型的1在四氯化钛催化下重排,会生成外消旋体2a和2b。 [5]

这些产物可以被解释为:1中羟基离去生成了一个三级碳正离子A,而这个三级碳正离子会重排成二级碳正离子B。氯可以从两边进攻这个碳正离子,从而得到两种差向异构体。
参考资料
[编辑]- ^ Additions to Alkenes: Regiochemistry. [2009-03-08]. (原始内容存档于2020-02-19).
- ^ W. Markownikoff. Ueber die Abhängigkeit der verschiedenen Vertretbarkeit des Radicalwasserstoffs in den isomeren Buttersäuren. Annalen der Pharmacie. 1870, 153 (1): 228–259. doi:10.1002/jlac.18701530204.
- ^ 3.0 3.1 Was Markovnikov’s Rule an Inspired Guess? Peter Hughes 1152 Journal of Chemical Education · Vol. 83 No. 8 August 2006
- ^ Highly Active in Situ Catalysts for Anti-Markovnikov Hydration of Terminal Alkynes. Aurélie Labonne, Thomas Kribber, and Lukas Hintermann Org. Lett.; 2006; 8(25) pp 5853 - 5856; (Letter) doi:10.1021/ol062455k
- ^ TiCl4 Induced Anti-Markovnikov Rearrangement Mugio Nishizawa, Yumiko Asai, and Hiroshi Imagawa Org. Lett.; 2006; 8(25) pp 5793 - 5796; (Letter) doi:10.1021/ol062337x.



