吡啶
| 吡啶 | |||
|---|---|---|---|
| |||
| |||

| |||
| IUPAC名 Pyridine | |||
| 别名 | 氮杂苯、py | ||
| 识别 | |||
| CAS号 | 110-86-1 | ||
| PubChem | 1049 | ||
| ChemSpider | 1020 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | JUJWROOIHBZHMG-UHFFFAOYAY | ||
| EINECS | 203-809-9 | ||
| ChEBI | 16227 | ||
| KEGG | C00747 | ||
| 性质 | |||
| 化学式 | C5H5N | ||
| 摩尔质量 | 79.101 g·mol⁻¹ | ||
| 外观 | 无色液体 | ||
| 氣味 | 不愉快的强烈气味 | ||
| 密度 | 0.9819 g/cm³ (液) | ||
| 熔点 | −41.6 ℃ | ||
| 沸点 | 115.2 ℃ | ||
| 溶解性(水) | 混溶 | ||
| 折光度n D |
1.5093[1] | ||
| 黏度 | 0.94 cP, 20 ℃ | ||
| 偶极矩 | 2.2 D[2] | ||
| 热力学 | |||
| ΔfHm⦵298K | 101.2 | ||
| ΔcHm⦵ | −2783.2 | ||
| 危险性 | |||
| 欧盟危险性符号 | |||
| 警示术语 | R:R20/21/22-R34-R36-R38 | ||
| NFPA 704 | |||
| 闪点 | 21 ℃ | ||
| 相关物质 | |||
| 相关胺 | 甲基吡啶、喹啉 | ||
| 相关化学品 | 苯胺、嘧啶、哌啶 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
吡啶[註 1](英語:Pyridine)是一種杂环化合物,化学式C5H5N。结构与苯有关,其中一組次甲基(=CH-)以氮原子取代。它是高度易燃、弱碱性、能与水混溶的液体,有令人不快的独特鱼腥味。
吡啶由苏格兰化学家托马斯·安德森(Thomas Anderson)于1849年在骨焦油中发现,两年后,安德森用分馏得到纯品。[4]其可燃,安德森以希臘語πῦρ(τὸ、pyr,意为火)命名。[5]吡啶的结构由Wilhelm Körner(于1869年)和詹姆斯·杜瓦(James Dewar,于1871年)分別独立确定。[6]
结构与性质
[编辑]分子结构
[编辑]吡啶结构是一粒氮原子取代了苯的一粒碳原子形成的化合物,是苯的等电子体。氮原子5粒电子中,1粒用来与其它碳原子形成大π键,因此吡啶仍有芳香性;氮原子又有负诱导效应,吡啶π电子云不均匀分布,其共振能小于苯(吡啶为117kJ·mol-1,苯为150kJ·mol-1)。[7]氮的诱导效应还反映在碳-氮键长(137 pm)小于苯环碳-碳键长,吡啶环的碳-碳键长与苯环相同(139 pm)。[8]吡啶氮的邻、间或对位碳原子再以氮取代生成化学式为C4H4N2的化合物依次为哒嗪,嘧啶,吡嗪。
物理性质
[编辑]吡啶在常温是无色液体,有刺激鱼腥味,熔点-41.6℃,沸点115.2℃,密度0.9819g/cm3。可与水、乙醚和乙醇等任意比例混合。[1]其本身也可作溶剂,可溶解各种有极性或无极性的化合物,甚至是无机盐。其溶解性与其他有机化合物有所不同的是:吡啶环上被取代的羟基越多,其在水中的溶解度反而下降。
化学性质
[编辑]吡啶是典型的杂环芳香化合物。吡啶氮的电负度高,比苯环缺电子,难起亲电取代反应,其在鄰位起亲电取代反应,与硝基苯类似。相反,吡啶能与强碱起亲核取代反应,例如齐齐巴宾反应。
吡啶能催化加氢,兰尼镍催化生成六氢吡啶(哌啶)。[9]反应热为-193.8 kJ·mol−1,[10]释放热量略小于苯催化加氢(205.3 kJ·mol−1)。钠与乙醇也可还原它为六氢吡啶。[11]
氮的孤对电子有叔胺性质,如吡啶有碱性,也是良好配体(作配体时记作py)。[12] 其共轭酸吡啶合氢离子的pKa为5.30。吡啶能与活泼卤代烃形成季铵盐;过氧化物氧化成N-氧化物。[13]
吡啶能起一系列自由基反应而二聚,用不同引发剂反应有选择性,如用钠得4,4'-联吡啶,兰尼镍得2,2'-联吡啶,[14][15]后者是化学工业中的重要的前体试剂。
来源
[编辑]吡啶可从天然煤焦油中获得,但煤焦油中只含约0.1%吡啶,需通过多级分馏,效率低下。[16]目前吡啶主要通过各种途径化学合成,例如乙醛和氨通过齐齐巴宾吡啶合成;醛、β-酮酯和和含氮化合物之间的汉奇吡啶合成。
齐齐巴宾合成首次发表于1924年,该方法至今仍用于吡啶的工业生产[17] 。反应需要高温(400-450 °C),以及过渡金属催化剂。

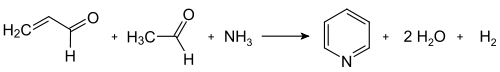
传统的齐齐巴宾反应制备非取代吡啶产量很低(约20%),且有大量副产物,未改进的版本现已很少使用[18] 。
在實驗室中,吡啶能够直接购买,或使用菸鹼酸在銅基催化劑下於300℃以上脫羧製備。
重排反应
[编辑]Ciamician-Dennstedt重排反应是吡咯或吲哚在强碱性条件下与卤仿(haloform)反应生成3-卤素-吡啶或3-卤素-喹啉的反应,最早由賈科莫·恰米奇安在1881年发现。[19]有时也被称为“反常”瑞穆尔-悌曼反应。

反应机理
[编辑]卤仿在强碱性条件下发生ɑ-消除反应得到卡宾,然后卡宾插入到吡咯富电子的π键上,最后扩环生成3-卤素-吡啶。


应用
[编辑]除作溶剂外,吡啶在工业上还可用作变性剂、助染剂,以及合成一系列产品的起始物,包括药品、消毒剂、染料、食品调味料、粘合剂、炸药等等。
毒性
[编辑]吡啶有毒,通过吸入、摄取或皮肤接触进入体内。[20]吡啶中毒急性的影响包括头晕,头痛,缺乏协调,恶心,流涎,食欲不振,可能发展成腹痛,肺淤血,神志不清。[21]人体的最低致死量(LDLO)为500 mg/kg。口服半数致死量(LD50)为891 mg/kg。高剂量的吡啶具有麻醉作用,其蒸气浓度超过3600 ppm将对健康构成威胁。[22]吡啶也可能有轻微的神经毒性,遗传毒性和诱导染色体断裂的影响。[23]
相关条目
[编辑]注释
[编辑]参考资料
[编辑]- ^ 1.0 1.1 Lide, p. 3–448
- ^ RÖMPP Online – Version 3.5. Thieme Chemistry (Stuttgart: Georg Thieme). 2009.
- ^ 吡. 现代汉语词典 第7版.
- ^ The products of the destructive distillation of animal substances "Transactions of the Royal Society of Edinburgh", 25, 1868, 205–16
- ^ Anderson, Th. Ueber die Producte der trocknen Destillation thierischer Materien. Annalen der Chemie und Pharmacie. 1851, 80: 44. doi:10.1002/jlac.18510800104.
- ^ A review on the Medicinal Importance of Pyridine Derivatives, 1, 2015, 1-11
- ^ Joule, p. 7
- ^ Elschenbroich, C. Organometallchemie, 6th ed., p. 218, Vieweg+Teubner, 2008, ISBN 978-3-8351-0167-8
- ^ Burrows, George H.; King, Louis A. The Free Energy Change that Accompanies Hydrogenation of pyridines to piperidines. Journal of the American Chemical Society. 1935, 57 (10): 1789. doi:10.1021/ja01313a011.
- ^ Cox, J. D. and Pilcher, G. (1970). Thermochemistry of Organic and Organometallic Compounds, Academic Press, New York, p. 1–636, ISBN 978-0-12-194350-9
- ^ 谷亨杰 等. 有机化学(第二版). 高等教育出版社, 2000.7. 一、吡啶及其衍生物. pp 386
- ^ Pal, Satyanarayan. Pyridine: A Useful Ligand in Transition Metal Complexes. 2018 [2020-02-14]. doi:10.5772/intechopen.76986. (原始内容存档于2021-01-04).
- ^ R. Milcent, F. Chau: Chimie organique hétérocyclique: Structures fondamentales, pp. 241–282, EDP Sciences, 2002, ISBN 978-2-86883-583-3
- ^ Badger, G; Sasse, W. Advances in Heterocyclic Chemistry Volume 2. Advances in Heterocyclic Chemistry 2: 179. 1963. ISBN 9780120206025. doi:10.1016/S0065-2725(08)60749-7.
- ^ Sasse, W. H. F. 2,2'-bipyridine (PDF). Organic Syntheses. 1966, 46: 5–8 [2013-08-17]. (原始内容 (PDF)存档于2012-01-21).
- ^ A. Gossauer: Struktur und Reaktivität der Biomoleküle, 2006, p. 488, Wiley-VCH Weinheim, ISBN 978-3-906390-29-1
- ^ Chichibabin, A. E. Über Kondensation der Aldehyde mit Ammoniak zu Pyridinebasen [On condensation of aldehydes with ammonia to make pyridines]. Journal für Praktische Chemie. 1924, 107: 122 [2017-01-19]. doi:10.1002/prac.19241070110. (原始内容存档于2018-09-20).
- ^ Frank, R. L.; Seven, R. P. Pyridines. IV. A Study of the Chichibabin Synthesis. Journal of the American Chemical Society. 1949, 71 (8): 2629–2635. doi:10.1021/ja01176a008.
- ^ Ciamician, G. L., Dennstedt, M. The effect of chloroform on the potassium salt of pyrroles. Ber. 1881, 14: 1153–1163.
- ^ Aylward, G, (2008), "SI Chemical Data 6th Ed.", ISBN 978-0-470-81638-7 (pbk.)
- ^ International Agency for Research on Cancer (IARC). Pyridine Summary & Evaluation. IARC Summaries & Evaluations. IPCS INCHEM. 22 August 2000 [17 January 2007]. (原始内容存档于2018-10-02).
- ^ S. Shimizu, N. Watanabe, T. Kataoka, T. Shoji, N. Abe, S. Morishita, H. Ichimura Pyridine and Pyridine Derivatives, in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a22_399
- ^ Record of Pyridine in the GESTIS Substance Database from the IFA







