亮氨酸拉链
外观

亮氨酸拉链(英語:leucine zipper,亦称为亮氨酸剪刀[1])是蛋白质中一种常见的三维结构模体,常见于许多转录因子的DNA结合结构域,因此涉及基因的表达调控。亮氨酸拉链在真核生物和原核生物的蛋白中都有发现,但以真核生物居多。
亮氨酸拉链是一种作为二聚体化结构域的超二级结构,且使相互平行的α-螺旋之间产生粘附力[2]。一个亮氨酸拉链包含了多个亮氨酸残基,通常每七个氨基酸残基就出现一次,这形成了一条两性的α-螺旋,疏水区只在其中一侧。这个疏水区提供了二聚化的区域,使得基序可以像“拉链”一样拉起来。此外,疏水亮氨酸区域对于其结合到DNA是不可或缺的。
结构
[编辑]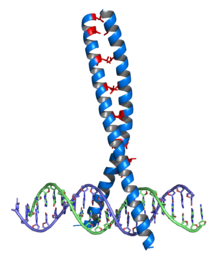
亮氨酸拉链结构域的主要特征是七肽重复的d位上大部分都是常见氨基酸——亮氨酸。通过对特定的一些转录因子的序列比对,发现这些转录因子形式都是每七个氨基酸出现一个亮氨酸,于是亮氨酸拉链首次鉴定出来。后来发现这些亮氨酸形成了卷曲螺旋的疏水核心。
亮氨酸拉链的每一半都是由每七个位置一个亮氨酸的短α-螺旋组成。标准的每一转3.6个残基的α-螺旋结构在亮氨酸拉链中发生了轻微的变化,形成了每一转3.5个残基的α-螺旋。与七肽重复一样,每条链每两转就有一个亮氨酸与另一条链上的亮氨酸发生接触。
转录因子中的bZIP家族由两个区域组成,其中之一是通过氢键与DNA的小沟发生作用的碱性区域,另一区域是承担二聚化作用的疏水性的亮氨酸拉链。
生物学
[编辑]亮氨酸拉链调节蛋白包括c-fos与c-jun(AP1转录因子),还有myc家族的成员包括myc、max与mdx1,它们是正常发育的重要调控物。如果它们在一些部位发生过量表达或突变,则会产生癌症。这些蛋白质以二聚体(同二聚体或异二聚体)的形式与DNA发生相互作用,又被称为碱性拉链蛋白(bZips)。
参考文献
[编辑]- ^ David M. Glick (编). Leucine scissors. Glossary of Biochemistry and Molecular Biology Revised. London: Portland Press. 1997.
- ^ Landschulz WH, Johnson PF, McKnight SL. The leucine zipper: a hypothetical structure common to a new class of DNA-binding proteins. Science. 1988-06-24, 240 (4860): 1759–1764. PMID 3289117. doi:10.1126/science.3289117.
