三氯氧磷[编辑]
| 三氯氧磷 | |
|---|---|

| |

| |
| IUPAC名 Phosphoryl chloride 或 Phosphorus oxide trichloride | |
| 别名 | 磷酰氯、氧氯化磷、氯氧化磷、三氯化氧化磷 |
| 识别 | |
| CAS号 | 10025-87-3 |
| PubChem | 24813 |
| ChemSpider | 23198 |
| SMILES | |
| InChI | |
| InChIKey | XHXFXVLFKHQFAL-UHFFFAOYAS |
| UN编号 | 1810 |
| EINECS | 233-046-7 |
| ChEBI | 30336 |
| RTECS | TH4897000 |
| 性质 | |
| 化学式 | POCl3 |
| 摩尔质量 | 153.33 g·mol⁻¹ |
| 外观 | 无色澄清液体 潮湿空气中发烟 |
| 密度 | 1.645 g/mL(液) |
| 熔点 | 1.25 °C (274.4 K) |
| 沸点 | 105.8 °C (379.0 K) |
| 溶解性(水) | 反应 |
| 结构 | |
| 分子构型 | 四面体 |
| 偶极矩 | 2.54 D |
| 危险性 | |
| 警示术语 | R:R14, R22, R26, R29, R35, R48/23 |
| 安全术语 | S:S26, S45, S7/8 |
| 主要危害 | 高度腐蚀性 催泪物质、有毒 |
| 相关物质 | |
| 相关化学品 | 三氯硫磷、三溴氧磷 三氯化磷、五氯化磷 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
三氯氧磷(分子式:POCl3),也称作磷酰氯,室温下为无色液体。它在潮湿空气中发烟,水解为磷酸及具刺激性的盐酸液滴。工业上由三氯化磷与氧气或五氧化二磷反应制备,主要用作生产磷酸酯如磷酸三甲苯酯。
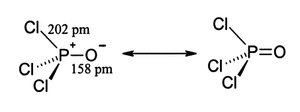
结构
[编辑]三氯氧磷中的磷原子为四面体构型,含有三个P-Cl键及一个P=O双键,P=O键离解能大约为533.5kJ/mol。根据键长及电负性的数据,Schomaker-Stevenson规则认为下列共振式中双键型的贡献较多,但同族的POF3中,贡献较多的则是电荷分离型结构。P=O双键与酮中的羰基π键也不相似,以前教材中认为磷d轨道与氧的p轨道交盖,现在则大多认为P-O键中的π键与P-Cl键σ*反键轨道有关,并不考虑d轨道的作用。
化学性质
[编辑]若反应中醇代替水,则产物为三烷基磷酸酯。此类反应常在吡啶或胺中进行,以吸收生成的HCl,推动反应进行。
路易斯酸如氯化锰催化下,POCl3与过量酚(ArOH)共热得到三芳基磷酸酯。例如与苯酚反应:
- 3 C6H5OH + O=PCl3 → O=P(OC6H5)3 + 3 HCl
POCl3也可以充當路易斯碱,与很多路易斯酸形成加合物。如与四氯化钛反应:
- Cl3P+-O− + TiCl4 → Cl3P+-O-−TiCl4
与氯化铝生成的加合物(POCl3·AlCl3)很稳定,POCl3也因此被用于从傅-克反应生成物中去除AlCl3。AlCl3存在下,POCl3与溴化氢反应生成POBr3。
制备
[编辑]三氯氧磷可通过三氯化磷与氧气在20-50 °C反应制备(使用空气效率较低):
或者利用五氯化磷与五氧化二磷的反应。但是反应物都为固态,反应效果不佳。用氯气氯化PCl3和P4O10的混合物,生成的PCl5同时再与P4O10反应,效果会好一些。产生的POCl3自身就可作反应溶剂:
五氯化磷水解时也会产生POCl3,但副反应较多,反应不易控制。
用途
[编辑]三氯氧磷最常用于生产三芳基磷酸酯(如磷酸三苯酯和磷酸三甲苯酯),它们可用作阻燃剂及聚氯乙烯的增塑剂。而三烷基磷酸酯如磷酸三丁酯(由1-丁醇通过类似反应制取)则是液液萃取的溶剂,用在核燃料后处理等工业中。
半导体工业中,也用POCl3作为扩散过程中磷的来源,以掺杂制取N型硅半导体。
实验室中用POCl3作为失水剂,将酰胺转化为腈。某些酰胺可通过Bischler-Napieralski反应环化,生成二氢异喹啉的衍生物:
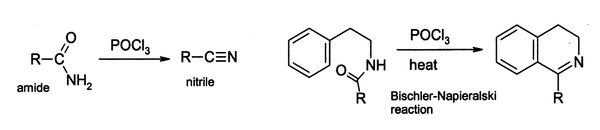
若上述反应经由的R-C(=NH)-Cl(imidoyl chloride)中间体足够稳定,则反应可停留在此阶段。比如,POCl3可使吡啶酮与嘧啶酮转化为相应的氯代产物,是医药工业中的重要前体。140 °C时,三氯氧磷与巴比妥酸反应生成2,4,6-三氯嘧啶:[1]

三氯氧磷存在下,活化的芳香环发生Vilsmeier-Haack反应,得到芳醛或芳酮。反应中的酰基化试剂常用DMF或N-苯基-N-甲基甲酰胺,中间产物亚胺盐很容易水解生成醛。例如,以蒽作反应物得到9-蒽甲醛:

参考资料
[编辑]- ^ R. C. Elderfield, Heterocyclic Compounds, Vol. 6, p 265-266, Wiley, New York, 1957. For trichloropyrimidine prep. see Gabriel & Colman, Berichte 37, 3657 (1904).
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- A. D. F. Toy, The Chemistry of Phosphorus, Pergamon Press, Oxford, UK, 1973.
- L. G. Wade, Jr., Organic Chemistry, 6th ed., p. 477, Pearson/Prentice Hall, Upper Saddle River, New Jersey, USA, 2005.
- B. J. Walker, Organophosphorus chemistry, p101-116, Penguin, Harmondsworth, UK, 1972.
- R. C. Elderfield, Heterocyclic Compounds, Vol. 6, p 265-266, Wiley, New York, 1957. For trichloropyrimidine prep. see Gabriel & Colman, Berichte 37, 3657 (1904).
- Formylation of anthracene. Organic Syntheses, Coll. Vol. 3, p.98; Vol. 20, p.11. (Article)