吞噬细胞

吞噬细胞为一类防卫细胞,它们通过吞噬细菌、坏死细胞和凋亡细胞等有害物质来保卫有机体。其原文“Phagocytes”的前半部来自古希腊语的“φαγεῖν”(phagein,意为“食用、吞食”),后半部“-cyte”为细胞(cell)的词缀,来自古希腊语的“κύτος”(kutos,意为“中空容器”)[1]。吞噬细胞在对抗感染以及后续的免疫过程中不可或缺[2],它在整个动物界中都相当重要[3],在脊椎动物体内特别发达[4]。一升的人类血液约含六十亿个吞噬细胞[5]。1882年,伊利亚·梅契尼可夫在研究海星幼虫时发现了吞噬细胞[6],并因此获得1908年诺贝尔生理医学奖[7]。一些阿米巴的行为亦与巨噬细胞(吞噬细胞的一种)相似,说明吞噬细胞在生命进化的早期阶段就已出现[8]。
吞噬细胞可由他们在吞噬过程中的特性分为专职(professional)与非专职(non-professional)的吞噬细胞[9],许多类型的白细胞都是专职吞噬细胞(如中性粒细胞、单核细胞、巨噬细胞、肥大细胞、树突状细胞等)[10]。专职吞噬细胞和非专职吞噬细胞的主要差别在于专职吞噬细胞表面具有受体分子,受体可以侦测细菌表面上一般不存在生物体内的分子[11]。吞噬细胞除了在对抗感染的过程中发挥很大的作用,它亦能清除坏死或凋亡的细胞,使生物的各种组织保持健康状态[12]。
在感染过程中,化学讯号使吞噬细胞前往病原体侵入处。这些化学物质可能来自细菌,也可能来自其它已经出现的吞噬细胞。吞噬细胞通过趋化作用进行移动。当吞噬细胞与细菌接触后,其表面的受体会与细菌结合,从而引导吞噬细胞将细菌吞噬[13],吞噬细胞随后利用活性氧类(ROS)以及一氧化氮杀死它所吞噬的细菌[14]。在吞噬完成后,巨噬细胞以及树突状细胞亦可参与抗原呈现的过程。在该过程中,吞噬细胞吞噬物质后会将其一部分转移到细胞表面,随后这些物质会展现给其它免疫细胞。一些吞噬细胞会移动到生物体的淋巴结,并将上述物质呈现给淋巴细胞(一种白细胞),此过程对建立特异性免疫相当重要[15]。但许多病原体都演化出了逃避吞噬细胞攻击的机制[2]。
历史
[编辑]
俄罗斯动物学家伊利亚·梅契尼可夫(1845–1916)为第一个发现吞噬细胞的人。1882年,他在研究海星幼虫体内的能动(自由移动)细胞时,相信这类细胞对动物的免疫防御相当重要。为了验证他的猜想,他将一段取自柑橘树的小木刺插入海星体内,几个小时后,他注意到能动细胞聚集在了木刺周围[16]。梅契尼可夫之后去了维也纳,和卡尔·克劳斯(Carl Friedrich Wilhelm Claus)分享他的想法。卡尔提议将梅契尼可夫发现的细胞命名为“phagocyte”[17]。“phagocyte”一词源于希腊语的“phagein”(吃,吞食)和“kutos”(中空容器)[1],中文则据此译为“吞噬细胞”。
一年之后,梅契尼可夫对水蚤进行研究,水蚤是一种微小且通体透明的淡水甲壳动物,可在显微镜下直接观察体内细胞,梅契尼可夫发现攻击水蚤的真菌都被水蚤的吞噬细胞消灭。他接着又观察哺乳动物的白细胞,发现吞噬细胞通过一种其所称为吞噬作用(phagocytosis)的过程吞食消灭掉炭疽杆菌(Bacillus anthracis,一种细菌)[18]。梅契尼可夫随后提出,吞噬细胞为机体针对入侵生物的防御体系的重要组成部分。
1903年,阿尔姆罗思·赖特发现吞噬作用能够通过特殊的抗体来强化,他称这种抗体为调理素(英语“Opsonin”来自希腊语“opson”,意即调味品)[19]。梅契尼可夫因为他对吞噬细胞和吞噬作用的研究在1908年和保罗·埃尔利希共享了诺贝尔生理医学奖[7]。
尽管人们在20世纪早期逐渐意识到这些发现的重要性,但吞噬细胞与免疫系统其他组成部分之间错综复杂的关系直到1980年代才得到阐明[20]。
吞噬作用
[编辑]
吞噬作用(Phagocytosis)是指细胞吞食细菌、寄生虫、死亡细胞、细胞残骸、和外来碎屑的过程[21],当中涉及了一连串的分子机制[22]。吞噬作用始于异物(这里以细菌为例)与吞噬细胞表面受体分子的结合,吞噬细胞随后运动到细菌周围,并将之吞食。人类的中性粒细胞吞噬细菌平均要花9分钟[23]。遭吞噬细胞吞入胞内的细菌会裹在吞噬小体内,并在一分钟内与溶酶体或颗粒融合,形成吞噬溶酶体。细菌随后会暴露在超量的杀灭性物质之中[24],并于几分钟后死亡[23]。树突状细胞以及巨噬细胞的吞噬速度相对较慢,这些细胞的吞噬作用可能长达数小时。巨噬细胞是巨大且似乎“什么都吃”的吞噬者,它们会吞噬大量的物质,并会将一些未消化的物质释放回组织,并将未消化的碎片作为信号,从血液中征募更多的吞噬细胞[25]。吞噬细胞相当“贪吃”,科学家还曾用铁屑来饲喂巨噬细胞,之后再用小磁铁将这些细胞吸出,以和其他细胞分离[26]。

吞噬细胞表面有许多种能和相关物质结合的受体[2],这些受体包括调理素受体、清道夫受体、Toll样受体等。调理素受体能与包覆在细菌表面的免疫球蛋白G(IgG)或补体结合以增强吞噬作用;补体是一系列复杂的血浆蛋白,能破坏细胞或将它们标记为摧毁对象[27]。清道夫受体能与细菌表面的许多分子结合。Toll样受体的名称来自于已有充分研究,且基因编码十分相近的果蝇铎受体,不过Toll样受体的专一性更强,Toll样受体与其配体的结合能使吞噬作用增强,也能使吞噬细胞施放一系列能引发炎症反应的激素[2]。
杀灭方法
[编辑]
杀灭微生物是吞噬细胞的一项重要功能[28]。吞噬细胞可在细胞内杀灭微生物(胞内杀灭),也可在细胞外杀灭微生物(胞外杀灭)。
氧依赖性胞内杀灭
[编辑]当吞噬细胞在吞食细菌(或其他物质)时,它的耗氧量会增加。这一耗氧量的增加称为呼吸爆发(Respiratory burst),目的是要产生能杀灭微生物的活性氧物质(ROS)[29]。ROS对侵入者和细胞本身都是有毒性的,因此,这些分子只存在细胞中特定的隔室内。这种通过ROS杀灭入侵的微生物的方法称为氧依赖性胞内杀灭(oxygen-dependent intracellular killing),并可再细分为两类[14]。
在第一种类型的杀灭中,氧依赖性产物是超氧化物[2],这是一种氧化力很强且具有杀菌活性的物质[30]。在超氧化物歧化酶的作用下,超氧化物转化为过氧化氢和单线态氧。超氧化物还会和过氧化氢反应,生成羟基自由基。羟基自由基能辅助杀灭入侵的微生物[2]。
在第二种类型的杀灭中,来自中性粒细胞颗粒的髓过氧化物酶会参与反应[31]。当颗粒与吞噬体融合为吞噬溶酶体后,髓过氧化物酶即能在其中进行反应。该酶会利用过氧化氢以及氯产生对细菌毒性很强的次氯酸盐,次氯酸盐在生活中也可用于漂白剂的制作[2]。髓过氧化物酶包含色素血红素,因此中性粒细胞的许多分泌物(如脓和感染痰液)会呈现绿色[32]。
非氧依赖性胞内杀灭
[编辑]
吞噬细胞也可以通过非氧依赖性的方法(oxygen-independent methods)杀死微生物,不过这类方法不如氧依赖性的方法有效。非氧依赖性胞内杀灭方法有四种主要的类型:第一种使用带电蛋白破坏细菌的质膜;第二种使用溶酶体,溶酶体中的酶能够破坏细菌的细胞壁;第三种使用乳铁蛋白,乳铁蛋白存在于中性粒细胞的颗粒中,它能从细菌胞内移除其生存必须的铁元素[33];第四种使用蛋白酶和水解酶,它们能消化细菌残骸的蛋白质[34]。
细胞外杀灭
[编辑]干扰素-γ(旧称巨噬细胞激活因子)能够诱导巨噬细胞产生并释放一氧化氮以杀灭周围的微生物[2],CD4+ T细胞、CD8+ T细胞、自然杀伤细胞(NK细胞)、B细胞、自然杀手T细胞(NKT细胞)、单核细胞、巨噬细胞、和树突状细胞都能产生干扰素-γ[35]。另外,激活的巨噬细胞能产生并分泌肿瘤坏死因子(TNF)作为信号分子[36],它们能够杀死癌细胞和病毒感染过的细胞,也能辅助激活其他免疫细胞[37]。
在慢性肉芽肿病等疾病中,由于患者氧依赖性杀灭途径受到异常干扰,吞噬细胞的效率降低,细菌反复性感染成为困扰患者的难题[38]。另外一些罕见的先天性疾病,如白细胞异常色素减退综合征(Chediak-Higashi syndrome),也和宿主杀死入侵的微生物的能力低下有关[39]。
病毒
[编辑]病毒只能在细胞内复制,它们借由宿主细胞表面的特定受体进入胞内。进入细胞后,病毒会控制宿主细胞的合成系统,产生数百份自身复制所需的物质。尽管吞噬细胞和其它先天免疫系统的成员能在一定程度上抑制病毒的扩散,但在病毒进入细胞后,适应性免疫(特别是淋巴细胞)才是防御的主力 [40]。在病毒感染的区域,淋巴细胞的数目常常远超过其它免疫细胞,这一现象在病毒性脑膜炎中很常见[41]。淋巴细胞杀死受病毒感染的细胞后,吞噬细胞会将其残骸清除[42]。
在细胞凋亡中的角色
[编辑]
动物体内的细胞会不断地死亡,细胞分裂和细胞死亡维持着成年个体细胞数目的稳定[12]。细胞有两种主要的死亡方式:坏死(necrosis)和凋亡(apoptosis)。细胞凋亡又称为“细胞程序性死亡”,是一个健康细胞正常功能的一部分;细胞坏死则通常由疾病或外伤造成。人体每天都必须要清理数十万已死亡或正在走向死亡的细胞,吞噬细胞在这个处理过程中扮演了重要角色[43]。
细胞凋亡末期的细胞[44]表面会出现磷脂丝氨酸等分子,这些表面分子能借由吞噬细胞辨识[45]。磷脂酰丝氨酸在正常情况下仅存在于质膜靠细胞质一侧的表面上,但在细胞凋亡时,磷脂酰丝氨酸会由“磷脂促翻转酶”(scramblase)移到到质膜的外侧(磷脂促翻转酶目前还未发现,只是一种假说中的蛋白)[46]。细胞表面的磷脂酰丝氨酸为该细胞进行了标记,使巨噬细胞上相应的受体能够加以辨识,并将该细胞吞噬[47]。通过吞噬细胞清理凋亡细胞的过程经过妥善安排,不会引发炎症反应,这也是吞噬细胞的一项重要功能[48]。
与其他细胞的相互作用
[编辑]吞噬细胞通常不会固着在特定的器官,而会在体内各处游走,并与其他组成免疫系统的吞噬细胞和非吞噬细胞发生相互作用。吞噬细胞通过“细胞因子”(或称细胞激素)与其他细胞进行信息交流,细胞因子能招募其他的吞噬细胞到感染区域,也可以刺激未激活的淋巴细胞[49]。吞噬细胞是动物(包括人类)先天免疫系统的一部分,先天免疫的效率很高,但却专一性却不高,即先天免疫无法精确针对入侵物质的种类而回以特殊的反应。另外一方面,有颌脊椎动物的后天免疫系统则具有高度的专一性,能够区分几乎所有种类的入侵物质[50]。相较于先天免疫系统以吞噬细胞为基础,后天免疫系统奠基于淋巴细胞。淋巴细胞能够分泌“抗体”(一种保护性蛋白质)来标记入侵物质,以便进行后续的清除程序。另外,抗体还能和病原体结合,使其丧失感染细胞的能力[51]。吞噬细胞,尤其是树突状细胞以及巨噬细胞,能够通过抗原呈递(antigen presentation)的进程刺激吞噬细胞产生抗体[52]。
抗原呈递
[编辑]
抗原呈递是吞噬细胞将吞噬物质的一部分搬运到细胞表面,并将它们呈递给其他免疫细胞的过程[53]。“专职的”的抗原呈递细胞共有两种:巨噬细胞和树突状细胞[54]。在吞噬异物后,外来蛋白(即抗原)会在巨噬细胞或树突状细胞胞内水解为多肽片段。随后,这些多肽会与细胞的主要组织相容性复合体(MHC,为糖蛋白)结合,携带着多肽的MHC会转运至吞噬细胞的表面,并将多肽“呈递”给淋巴细胞[15]。成熟的巨噬细胞并不会离开感染区域太远,不过树突状细胞能移动到含有数百万淋巴细胞的淋巴结处[55]。这一过程中,树突状细胞将多肽呈现给淋巴细胞,使淋巴细胞对多肽产生专一性的抗体(这种反应和淋巴细胞直接在感染区域接触抗原后产生的应答是等效的),增加免疫反应的强度[56]。除此以外,树突状细胞还可以杀灭或抑制对自体组织有反应的淋巴细胞——这对阻止自体免疫反应的发生至关重要,此一过程称为“(免疫)耐受”[57]。
免疫耐受
[编辑]树突状细胞对免疫耐受的产生十分重要[58],免疫耐受性使得免疫系统不会攻击自身的组织。第一类免疫耐受为发生于胸腺中的中枢耐受(central tolerance),主要的机制是让与自身抗原(由胸腺中的上皮网状细胞呈递)结合得过于紧密的T细胞死亡。第二类免疫耐受是外周耐受(peripheral tolerance),因为许多可能的原因(其中一种主要原因是胸腺中自身抗原表达的缺乏),对自身组织有反应的T细胞会逃离胸腺,这时候调节性T细胞就可以降低这些T细胞的活性[59]。一旦免疫耐受失效,个体就可能患上自体免疫疾病[60]。
专职吞噬细胞
[编辑]
人类以及其他有颌类脊椎动物的吞噬细胞都能够依照其吞噬作用的效率分为专职及非专职两种[9]。专职吞噬细胞包括单核细胞、巨噬细胞、中性粒细胞、组织树突状细胞、和肥大细胞[10]。一升人类血液含有约60亿个吞噬细胞[5]。
激活
[编辑]所有的吞噬细胞,尤其是巨噬细胞,在一定程度上都已经准备好要激活。巨噬细胞在组织中通常较不活跃,增殖速度很慢;在此种休止状态中,巨噬细胞能清除死亡的个体细胞和其他非感染性碎片,但几乎不参与抗原呈递。但当感染发生后,巨噬细胞会受到化学信号(通常是干扰素-γ)的刺激而生产更多的MHCII分子,做好参与抗原呈递的准备;在此种激活的状态下,巨噬细胞是一个优秀的抗原呈递者兼杀手。然而,此时巨噬细胞若直接接触到入侵者,它们就会进入“超激活态”(hyperactivated),即停止增殖,并专注于杀灭;此时巨噬细胞的大小和吞噬速率都会增加,有时甚至可以长大到足以吞食原生生物[61]。
在血液中,中性粒细胞虽然处于非激活态,但却以很快的速度循环。在收到发炎处巨噬细胞的信号后,它们会减慢速度、离开血液、进入组织中,并由细胞因子激活,抵达战场的第一线进行杀灭[62]。
迁移
[编辑]
感染发生后,吞噬细胞会在感染处的求救化学信号(称为趋化因子)诱导之下前往该处[63],这些化学信号可能是入侵细菌的蛋白质、凝血系统的多肽、补体产物、或感染处巨噬细胞所释出的细胞因子[2];另外,也有一些趋化因子是用于征募中性粒细胞以及单核细胞的[13]。
为了抵达感染区域,吞噬细胞必须穿过血管才能进入受影响的组织中。感染传出的信号使血管内皮细胞产生选凝素(一种细胞表面的粘连蛋白),中性粒细胞表面的选择素配体会与内皮上的选择素结合,这使得中性粒细胞能在发炎处停下,并接着穿越内皮、进入组织。另外一些化学信号能诱导血管扩张,使血管内皮细胞之间的连接变得较松散,以便吞噬细胞穿过管壁。趋化作用指吞噬细胞受到细胞因子的吸引而移动到感染区域的过程[2]。 中性粒细胞穿过上皮细胞所包覆的器官以到达感染区域,尽管这是对抗感染重要的一步,但迁移的过程本身也可能会导致类似疾病的症状[64]。在感染过程中,数百万的中性粒细胞会从血液中投身至感染处,不过它们都会在数日后死亡[65]。
单核细胞
[编辑]
单核细胞于骨髓中发育,在血液中成熟。成熟的单核细胞体积大、表面光滑、有分叶的核(常呈肾形),且细胞质拥有大量颗粒。单核细胞能摄取外源或具危险性的物质,并将抗原呈递给其他免疫细胞。单核细胞可分为两种群体:循环群体(约30%)以及滞留在特定组织中的边缘群体(约70%)。大部分的单核细胞会在20至40小时后离开血液,进入组织和器官之中,依照收到的信号[66]分化为巨噬细胞[67]或树突状细胞。一升人类血液中约有5亿个单核细胞[5]。
巨噬细胞
[编辑]
成熟的巨噬细胞不会作远距移动,而会在特定几个身体与外界接触的区域巡逻。在这些区域中,依收到的信号不同,他们可能会扮演清道夫、抗原呈递者、或是杀手的角色[68]。巨噬细胞分化自单核细胞、粒细胞干细胞、或来现存巨噬细胞的分裂。巨噬细胞具有分裂能力,能通过分裂产生更多巨噬细胞[69]。人类巨噬细胞的直径大约是21微米[70]。
巨噬细胞胞内没有颗粒,但有很多的溶酶体。人体几乎所有的组织和器官中都有巨噬细胞(比如大脑中的微胶细胞、肺中的肺泡巨噬细胞),不过平时他们都处于休止的状态。巨噬细胞所处的位置可决定其大小和形状。它们可以产生白细胞介素1族(IL-1)、白细胞介素6(IL-6)、肿瘤坏死因子-α(TNF-α)来引起发炎反应[71]。巨噬细胞大都分布在组织中,血液中几乎找不到它们的踪迹。组织中巨噬细胞的寿命从4天到15天不等[72]。
巨噬细胞在激活后,可拥有一些休止的单核细胞没有的功能[71]。辅助T细胞(Th细胞)通过细胞因子干扰素-γ或表面蛋白CD40配体来激活巨噬细胞[73];此外,TNF-α以及细菌的脂多糖同样也能作为激活的信号[71]。第一型辅助T细胞(Th1)能够通过多种方法征募吞噬细胞到感染区域:它们可以分泌某些细胞因子到骨髓中刺激单核细胞和中性粒细胞产生,也能分泌另一些细胞因子促使单核细胞和中性粒细胞离开血液[74]。Th1细胞分化自在二级淋巴组织中受到抗原刺激的CD4+T细胞[71]。激活的巨噬细胞也能通过产生TNF-α、干扰素-γ、一氧化氮、活性氧化合物、阳离子蛋白、水解酶等物质来杀灭肿瘤[71]。
中性粒细胞
[编辑]
中性粒细胞长期存在于人类的血液中,是数量最多的吞噬细胞,占血液中白细胞数目的50%到60%[75]。一升的人类血液大约含有50亿个中性粒细胞[5]。中性粒细胞的直径约10微米[76],寿命约5天[37]。它们在收到恰当信号后,需要花约30分钟离开血液前往感染区域[77]。它们能迅速吞食与抗体或补体结合的入侵物质、受损的细胞、和细胞碎片。随后,中性粒细胞不会回到血液中,它们会在转化为脓细胞后死亡[77]。成熟的中性粒细胞体积较单核细胞小,核多叶(通常为2到5叶),不同叶之间由染色体纤丝连结。中性粒细胞通常在成熟后才会离开骨髓,不过在感染发生时,中性粒细胞的前趋细胞幼粒细胞以及早幼粒细胞亦会自骨髓中释出[78]。
研究者很早就发现人类中性粒细胞内的颗粒有摧毁蛋白质以及杀灭细菌的作用[79]。中性粒细胞分泌的物质能刺激单核细胞以及巨噬细胞,增强吞噬作用以及活性氧物质的产生[80]。由中性粒细胞初级颗粒分泌出的物质能刺激吞噬细胞吞食抗体内包覆的细菌[81]。
树突状细胞
[编辑]
树突状细胞是特化的抗原呈递细胞。这类细胞表面有大量的树突状突出[82],这些突出可以帮助它们吞食细菌等入侵物质[83][84]。树突状细胞在皮肤、鼻子内侧、肺、胃,以及肠等与外界接触的组织中都有分布[85]。在激活后,树突状细胞会并移动到淋巴细胞中与T细胞和B细胞发生作用,协助启动适应性免疫反应[86]。成熟的树突状细胞能激活辅助型T细胞以及细胞毒性T细胞[87],激活的辅助型T细胞则能激活巨噬细胞和B细胞。另外,树突状细胞也会影响后续产生的免疫反应类型:当它们移动到富含T细胞的淋巴组织时,就能激活T细胞,使它们分化为细胞毒性T细胞或辅助型T细胞[83]。
肥大细胞
[编辑]肥大细胞拥有Toll样受体,能与树突状细胞、B细胞、和T细胞相互作用,帮助介导适应性免疫反应[88]。肥大细胞能生产MHCII分子,并参与抗原呈递,但其在抗原呈递中扮演的角色目前并未得到充分研究[89]。肥大细胞可以吞食并杀灭革兰氏阴性菌(比如沙门氏菌),并在处理其抗原后将之呈递给T细胞[90]。肥大细胞对细菌表面菌毛蛋白的处理特别在行,菌毛使细菌能黏附在生物体组织上[91][92]。除了这些作用外,肥大细胞还可以产生细胞因子诱导炎症反应[93],炎症反应可吸引更多的免疫细胞到感染发生的区域,因此对身体防御相当重要[90]。
| 位置 | 种类 |
|---|---|
| 血液 | 单核细胞、中性粒细胞 |
| 骨髓 | 巨噬细胞、单核细胞、窦内皮细胞、上皮细胞 |
| 骨组织 | 蚀骨细胞 |
| 肠道及培氏斑块 | 巨噬细胞 |
| 固有结缔组织 | 组织细胞、巨噬细胞、单核细胞、树突状细胞 |
| 肝 | 库普弗细胞、单核细胞 |
| 肺 | 能自我复制的巨噬细胞、单核细胞、肥大细胞、树突状细胞 |
| 淋巴组织 | 自由及固着巨噬细胞、单核细胞、树突状细胞 |
| 神经组织 | 微胶细胞(CD4+) |
| 脾 | 自由及固着巨噬细胞、单核细胞、窦内皮细胞 |
| 胸腺 | 自由及固着巨噬细胞、单核细胞 |
| 皮肤 | 原生的朗格汉斯细胞、其他类型的树突状细胞、普通巨噬细胞、肥大细胞 |
非专职吞噬细胞
[编辑]走向死亡的细胞以及侵入体内的外来生物也能由“专职”吞噬细胞以外的细胞吞食[95],这些细胞包括上皮细胞、内皮细胞、成纤维细胞,以及间质干细胞。将它们称为非专职吞噬细胞(non-professional phagocytes)是为了强调其与专职吞噬细胞的不同,吞噬不是它们最主要的功能[96]。举例来说,成纤维细胞在疤痕的重塑过程中会吞噬胶原蛋白,同时也会尝试消化外来颗粒[97]。
非专职吞噬细胞能吞噬的颗粒种类比专职吞噬细胞少,这是因为它们缺乏高效的吞噬受体──特别是调理素受体。调理素是指由免疫系统产生而能协助吞噬的物质,它们通常是能与入侵物质结合的抗体或补体[11]。另外,大多数的非专职吞噬细胞都不能产生用以杀灭的活性氧物质[98]。
浆细胞
[编辑]
浆细胞(Plasma cell),亦称为效应B细胞(effector B cell),是免疫系统中释放大量抗体的细胞。直径10-20μm,细胞核较小,占细胞的一半以下,多偏于一侧,偶尔可有双核。浆细胞的染色质粗密、 聚集成堆、常呈紫丁香色、不均匀,在近核处一边常伸出半月状淡染区;浆中偶见有空泡或有泡沫感。
| 主要位置 | 类型 |
|---|---|
| 血液、淋巴以及淋巴结 | 淋巴细胞 |
| 血液、淋巴以及淋巴结 | 自然杀手细胞(NK细胞) 大颗粒淋巴细胞(LGL细胞) |
| 皮肤 | 上皮细胞 |
| 血管 | 内皮细胞 |
| 结缔组织 | 成纤维细胞 |
| 血液 | 红细胞 |
病原体的逃避和抵抗
[编辑]
病原体必须回避生物体的防御才能成功入侵。致病性微生物(包括致病菌以及具有致病能力的原生动物)有一系列抵御吞噬细胞攻击的方法,许多致病性微生物通过这些方式存活下来,或甚至在吞噬细胞内进行复制[99][100]。
避免接触
[编辑]细菌利用多种方式避免与吞噬细胞接触。有些细菌可以在吞噬细胞无法到达的地方生长(比如完整的皮肤表面);有些则能抑制炎症反应,缺乏发炎反应将使吞噬细胞无法产生足够强度的回应;有些细菌则能以化学毒素干扰吞噬细胞,使其无法到达感染区域[99];最后,一些细菌可以误导免疫系统,将自己伪装成宿主自体的一部分而躲过攻击,例如梅毒螺旋体(Treponema pallidum)的表面有纤连蛋白[101],而纤连蛋白是伤口愈合的过程中具有重要功能的人体蛋白[102]。
避免吞食
[编辑]细菌通常会在其表面产生一层蛋白质或糖类所构成的荚膜包覆自身,以干扰吞噬作用的进行[99]。大肠杆菌(E.coil)表面的K5荚膜和O-抗原[103]、表皮葡萄球菌(Staphylococcus epidermidis)的外多糖荚膜等都是很好的例子[104]。肺炎链球菌(Streptococcus pneumoniae)能产生数种不同的荚膜,它们能提供不同程度的保护[105]。A群链球菌则能产生M蛋白以及菌毛蛋白来对抗吞噬作用。一些细菌能阻止与调理素介导的吞噬作用,如金黄色葡萄球菌(S.aureus)产生的蛋白A可以阻止抗体受体和抗体结合,减弱调理素的作用[106]。
在吞噬细胞胞内生存
[编辑]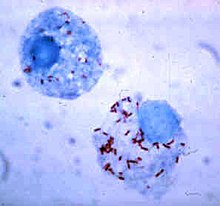
细菌发展出了各式各样的方法使它们能在吞噬细胞胞内存活,躲在其中回避免疫系统的攻击[107]。为了能安全地待在吞噬细胞内,细菌会表达一种名为“侵染素”(invasin)的蛋白,并设法留在细胞质中,以避免吞噬溶酶体内的有毒化学物质攻击[108]。一些细菌能阻止溶酶体和吞噬体融合,使吞噬溶酶体无法生成[99]。利什曼原虫(Leishmania)等病原体可以在吞噬细胞胞内形成高度特化的液泡,帮助它们在吞噬细胞内生存与繁殖[109]。一些细菌可以在吞噬溶酶体内存活,如金黄色葡萄球菌可以产生过氧化氢酶和超氧化物歧化酶来分解吞噬细胞所产生的杀菌物质(如过氧化氢)[110]。细菌也可能在吞噬溶酶体生成前从吞噬体中逃亡,如李斯特菌(Listeria monocytogenes)可以用李斯特菌溶血素O(listeriolysin O)和磷脂酶C在吞噬体的膜上打洞[111]。
杀灭吞噬细胞
[编辑]细菌已经发展出一些途径来杀死吞噬细胞[106]。溶细胞素能造成吞噬细胞膜上产生孔洞;链球菌溶血素(streptolysin)以及杀白细胞素(leukocidin)则能使中性粒细胞细胞质中的颗粒破裂,其内的有毒物质于是释放到胞质当中[112][113];外毒素亦能杀死吞噬细胞,这种分子能使吞噬作用必须的ATP供应短缺。细菌在吞噬细胞吞食后就能释放上述毒素,毒素会穿过吞噬体或吞噬溶酶体的膜到达目标作用部位,进而杀死吞噬细胞[99]。
干扰细胞信号传送
[编辑]入侵者常用的生存策略还包括干扰细胞因子或其他细胞信号传送途径,以阻断吞噬细胞对入侵的回应[114]。原生生物寄生虫如弓形虫(Toxoplasma gondii)、克氏锥虫(Trypanosoma cruzi)、和利什曼原虫(Leishmania)能够感染巨噬细胞,并通过各自独特的方法“驯服”巨噬细胞[114]。举例来说,某些种类的利什曼原虫可以改变巨噬细胞的信号传送,抑制细胞因子和杀菌物质(一氧化氮和活性含氧物质等)的产生,并阻遏巨噬细胞进行抗原呈递[115]。
吞噬细胞造成的自体损伤
[编辑]巨噬细胞以及中性粒细胞能施放蛋白质和小分子发炎介质(inflammatory mediators),在发炎过程中发挥着至关重要的作用。这些分子能控制感染,但不会造成自体组织的损伤。吞噬细胞消灭病原体的方式是将它们吞食后送入含有多种毒性化学物质的吞噬溶酶体中;如果一个吞噬细胞未能将其目标吞食,上述的毒物就可能释放到坏境中(这一过程称为“吞噬受挫”(frustrated phagocytosis))。因为这些物质对自体细胞也是有毒的,它们可能会对健康的细胞和组织造成严重损伤[116]。
如果中性粒细胞将它们的颗粒在肾脏中释放,颗粒中的物质(活性氧化合物、蛋白水解酶)会降解细胞外基质,并对肾小球细胞产生损伤,不仅会使这类细胞的形态发生改变,还会使它们滤血的功能受损;此外,磷脂酶的酶解产物(比如白三烯)也会加剧损伤。这类物质的释放会通过趋化作用促进更多的中性粒细胞到达感染区域。肾小球细胞在中性粒细胞迁移过程中,也会受到黏附分子的进一步损伤。肾小球细胞的损伤可能造成肾功能衰竭[117]。
中性粒细胞在多数类型的急性呼吸窘迫综合征中也扮演着关键角色[118],激活的中性粒细胞会将含有毒性物质的颗粒释放入肺部[119]。实验表明中性粒细胞数量的减少能减缓急性呼吸窘迫综合征的症状[120],但抑制中性粒细胞的疗法在临床上却并不现实,因为这样做会使患者无力抵抗伺机性感染[119]。在肝脏中,细菌所释放的内毒素、败血症、创伤、酒精性肝炎、缺血、和大出血造成的低血容量性休克都会使中性粒细胞对上述情形做出反应,而造成肝损伤或功能缺失[121]。
巨噬细胞释放的化学物质亦可能造成自身组织的损伤。肿瘤坏死因子-α(TNF-α)是一种由巨噬细胞释放的细胞激素,它可使小血管中的血液凝固,阻止感染的扩散[122]。然而,如果细菌感染已经扩散到血液中,TNF-α就会通过血液流入重要的器官,这会导致血管扩张和血浆体积减少,诱发感染性休克。感染性休克发生后,TNF-α的释放会使为重要器官供血的小血管堵塞,造成器官停止工作,并可能导致死亡[13]。
演化起源
[编辑]吞噬作用在各种生物中十分常见,可能在演化早期就已经出现[123]。吞噬细胞一开始可能是类似变形虫的单细胞真核生物[124],变形虫是一类单细胞原生生物,相较于植物,动物和它们的亲缘关系更为接近。变形虫与吞噬细胞有许多共通的功能特色[124],比如盘基网柄菌(Dictyostelium discoideum)是一种生活在土壤和草料中的变形虫,它们以细菌为食,主要借由Toll样受体吞噬细菌,并还有许多与吞噬细胞相同的功能[125]。盘基网柄菌的群落具有社会性,饥饿时它们会聚集在一起,生成一团蛞蝓状的假合胞,这个多细胞群体最后会形成有孢子的子实体来对抗危险环境。在子实体生成前,细胞会以蛞蝓状假合胞的型态迁移数天,这期间接触到的致病细菌或毒素可能会阻碍孢子产生,使物种生存受到威胁。不过,一些在假合胞中循环的变形虫细胞会吞噬有害的细菌或吸收毒素,并在完成上述过程后死亡;这些细胞和假合胞中的其它变形虫细胞在遗传上完全相同。它们以自我牺牲的方式保护其它变形虫细胞不受细菌侵害,这和脊椎动物免疫系统中吞噬细胞的自我牺牲行为相似,有理论因此推测变形虫的吞噬作用可能与动物界的吞噬细胞的作用同源[126]。然而,哺乳动物吞噬细胞和变形虫的同源关系还未经证实。吞噬细胞存在于几乎所有动物界成员[3],不论是海绵动物、节肢动物、高等或低等的脊椎动物体内都有吞噬细胞[127][128]。变形虫区别自我和非我的能力非常重要,是许多变形虫免疫系统的根基[8]。
参考文献
[编辑]引用
[编辑]- ^ 1.0 1.1 Little, C., Fowler H.W., Coulson J. The Shorter Oxford English Dictionary. Oxford University Press (Guild Publishing). 1983: 1566–67.
- ^ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 Delves et al. 2006,第2–10页
- ^ 3.0 3.1 Delves et al. 2006,第250页
- ^ Delves et al. 2006,第251页
- ^ 5.0 5.1 5.2 5.3 Hoffbrand, Pettit & Moss 2005,第331页
- ^ Ilya Mechnikov (页面存档备份,存于互联网档案馆), retrieved on 2008-11-28. From Nobel Lectures (页面存档备份,存于互联网档案馆), Physiology or Medicine 1901–1921, Elsevier Publishing Company, Amsterdam, 1967.
- ^ 7.0 7.1 Schmalstieg, FC; AS Goldman. Ilya Ilich Metchnikoff (1845–1915) and Paul Ehrlich (1854–1915): the centennial of the 1908 Nobel Prize in Physiology or Medicine. Journal of medical biography. 2008, 16 (2): 96–103 [2014-12-19]. PMID 18463079. doi:10.1258/jmb.2008.008006. (原始内容存档于2011-07-24).
- ^ 8.0 8.1 Janeway, Chapter: Evolution of the innate immune system. retrieved on 2009-01-20
- ^ 9.0 9.1 Ernst & Stendahl 2006,第186页
- ^ 10.0 10.1 Robinson & Babcock 1998,第187页 and Ernst & Stendahl 2006,第7–10页
- ^ 11.0 11.1 Ernst & Stendahl 2006,第10页
- ^ 12.0 12.1 Thompson, CB. Apoptosis in the pathogenesis and treatment of disease. Science. 1995, 267 (5203): 1456–62. PMID 7878464. doi:10.1126/science.7878464.
- ^ 13.0 13.1 13.2 Janeway, Chapter: Induced innate responses to infection.
- ^ 14.0 14.1 Fang FC. Antimicrobial reactive oxygen and nitrogen species: concepts and controversies. Nat. Rev. Microbiol. 2004-10, 2 (10): 820–32. PMID 15378046. doi:10.1038/nrmicro1004.
- ^ 15.0 15.1 Delves et al. 2006,第172–84页
- ^ Delves et al. 2006,第3页
- ^ Aterman, Kurt. Medals, Memoirs-and Metchnikoff. Journal of Leukocyte Biology. 1998, 63 (4): 515–517. ISSN 0741-5400. doi:10.1002/jlb.63.4.515.
- ^ Ilya Mechnikov. The Nobel Foundation. [2014-12-19]. (原始内容存档于2015-02-17).
- ^ Delves et al. 2006,第263页
- ^ Robinson & Babcock 1998,第vii页
- ^ Ernst & Stendahl 2006,第4页
- ^ Ernst & Stendahl 2006,第78页
- ^ 23.0 23.1 Hampton, Mark B.; Vissers, Margret C. M.; Winterbourn, Christine C. A single assay for measuring the rates of phagocytosis and bacterial killing by neutrophils. Journal of Leukocyte Biology. 1994, 55 (2): 147–152. ISSN 0741-5400. doi:10.1002/jlb.55.2.147.
- ^ Delves et al. 2006,第6–7页
- ^ Sompayrac 2008,第3页
- ^ Sompayrac 2008,第2页
- ^ Sompayrac 2008,第13–16页
- ^ Dale DC, Boxer L, Liles WC; Boxer; Liles. The phagocytes: neutrophils and monocytes. Blood. 2008-08, 112 (4): 935–45 [2014-12-19]. PMID 18684880. doi:10.1182/blood-2007-12-077917. (原始内容存档于2016-12-20).
- ^ Dahlgren, C; A Karlsson. Respiratory burst in human neutrophils. Journal of Immunological Methods. 1999-12-17, 232 (1–2): 3–14. PMID 10618505. doi:10.1016/S0022-1759(99)00146-5.
- ^ Shatwell, KP; AW Segal. NADPH oxidase. The international journal of biochemistry and cell biology. 1996, 28 (11): 1191–95. PMID 9022278. doi:10.1016/S1357-2725(96)00084-2.
- ^ Klebanoff SJ. Myeloperoxidase. Proc. Assoc. Am. Physicians. 1999, 111 (5): 383–89. PMID 10519157.
- ^ Meyer KC. Neutrophils, myeloperoxidase, and bronchiectasis in cystic fibrosis: green is not good. J. Lab. Clin. Med. 2004-09, 144 (3): 124–26 [2014-12-19]. PMID 15478278. doi:10.1016/j.lab.2004.05.014. (原始内容存档于2021-08-14).
- ^ Hoffbrand, Pettit & Moss 2005,第118页
- ^ Delves et al. 2006,第6–10页
- ^ Schroder K, Hertzog PJ, Ravasi T, Hume DA; Hertzog; Ravasi; Hume. Interferon-gamma: an overview of signals, mechanisms and functions. J. Leukoc. Biol. 2004-02, 75 (2): 163–89 [2014-12-19]. PMID 14525967. doi:10.1189/jlb.0603252. (原始内容存档于2010-07-03).
- ^ Delves et al. 2006,第188页
- ^ 37.0 37.1 Sompayrac 2008,第17页
- ^ Lipu HN, Ahmed TA, Ali S, Ahmed D, Waqar MA; Ahmed; Ali; Ahmed; Waqar. Chronic granulomatous disease. J Pak Med Assoc. 2008-09, 58 (9): 516–18. PMID 18846805.
- ^ Kaplan J, De Domenico I, Ward DM; De Domenico; Ward. Chediak-Higashi syndrome. Curr. Opin. Hematol. 2008-01, 15 (1): 22–29 [2014-12-19]. PMID 18043242. doi:10.1097/MOH.0b013e3282f2bcce. (原始内容存档于2012-05-11).
- ^ Sompayrac 2008,第7页
- ^ de Almeida SM, Nogueira MB, Raboni SM, Vidal LR; Nogueira; Raboni; Vidal. Laboratorial diagnosis of lymphocytic meningitis. Braz J Infect Dis. 2007-10, 11 (5): 489–95 [2014-12-19]. PMID 17962876. doi:10.1590/s1413-86702007000500010. (原始内容存档于2015-01-03).
- ^ Sompayrac 2008,第22页
- ^ Sompayrac 2008,第63页
- ^ Apoptosis. Merriam-Webster Online Dictionary. [2014-12-19]. (原始内容存档于2015-01-03).
- ^ Li MO, Sarkisian MR, Mehal WZ, Rakic P, Flavell RA; Sarkisian; Mehal; Rakic; Flavell. Phosphatidylserine receptor is required for clearance of apoptotic cells. Science. 2003-11, 302 (5650): 1560–63 [2014-12-19]. PMID 14645847. doi:10.1126/science.1087621. (原始内容存档于2008-01-19). (Free registration required for online access)
- ^ Wang X. Cell corpse engulfment mediated by C. elegans phosphatidylserine receptor through CED-5 and CED-12. Science. 2003, 302 (5650): 1563–1566 [2016-06-17]. PMID 14645848. doi:10.1126/science.1087641. (原始内容存档于2008-05-21). (Free registration required for online access)
- ^ Savill J, Gregory C, Haslett C. Eat me or die. Science. 2003, 302 (5650): 1516–17. PMID 14645835. doi:10.1126/science.1092533.
- ^ Zhou Z, Yu X; Yu. Phagosome maturation during the removal of apoptotic cells: receptors lead the way. Trends Cell Biol. 2008-10, 18 (10): 474–85. PMC 3125982
 . PMID 18774293. doi:10.1016/j.tcb.2008.08.002.
. PMID 18774293. doi:10.1016/j.tcb.2008.08.002.
- ^ Sompayrac 2008,第44页
- ^ Sompayrac 2008,第4页
- ^ Sompayrac 2008,第24–35页
- ^ Delves et al. 2006,第171–184页
- ^ Delves et al. 2006,第456页
- ^ Timothy Lee. Antigen Presenting Cells (APC). Immunology for 1st Year Medical Students. Dalhousie University. 2004 [2014-12-19]. (原始内容存档于2008-01-12).
- ^ Delves et al. 2006,第161页
- ^ Sompayrac 2008,第8页
- ^ Delves et al. 2006,第237–242页
- ^ Lange C, Dürr M, Doster H, Melms A, Bischof F; Dürr; Doster; Melms; Bischof. Dendritic cell-regulatory T-cell interactions control self-directed immunity. Immunol. Cell Biol. 2007, 85 (8): 575–81. PMID 17592494. doi:10.1038/sj.icb.7100088.
- ^ Steinman, Ralph M. Dendritic Cells and Immune Tolerance. The Rockefeller University. 2004 [2014-12-19]. (原始内容存档于2009-03-11).
- ^ Romagnani, S. Immunological tolerance and autoimmunity. Internal and emergency medicine. 2006, 1 (3): 187–96. PMID 17120464. doi:10.1007/BF02934736.
- ^ Sompayrac 2008,第16–17页
- ^ Sompayrac 2008,第18–19页
- ^ Delves et al. 2006,第6页
- ^ Zen K, Parkos CA; Parkos. Leukocyte-epithelial interactions. Curr. Opin. Cell Biol. 2003-10, 15 (5): 557–64 [2014-12-19]. PMID 14519390. doi:10.1016/S0955-0674(03)00103-0. (原始内容存档于2018-11-07).
- ^ Sompayrac 2008,第79页
- ^ Delves et al. 2006,第1–6页
- ^ Hoffbrand, Pettit & Moss 2005,第117页
- ^ Sompayrac 2008,第45页
- ^ Takahashi K, Naito M, Takeya M; Naito; Takeya. Development and heterogeneity of macrophages and their related cells through their differentiation pathways. Pathol. Int. 1996-07, 46 (7): 473–85. PMID 8870002. doi:10.1111/j.1440-1827.1996.tb03641.x.
- ^ Krombach F, Münzing S, Allmeling AM, Gerlach JT, Behr J, Dörger M; Münzing; Allmeling; Gerlach; Behr; Dörger. Cell size of alveolar macrophages: an interspecies comparison. Environ. Health Perspect. 1997-09,. 105 Suppl 5 (Suppl 5): 1261–63. JSTOR 3433544. PMC 1470168
 . PMID 9400735. doi:10.2307/3433544.
. PMID 9400735. doi:10.2307/3433544.
- ^ 71.0 71.1 71.2 71.3 71.4 Delves et al. 2006,第31–36页
- ^ Ernst & Stendahl 2006,第8页
- ^ Delves et al. 2006,第156页
- ^ Delves et al. 2006,第187页
- ^ Stvrtinová, Viera; Ján Jakubovský and Ivan Hulín. Neutrophils, central cells in acute inflammation. Inflammation and Fever from Pathophysiology: Principles of Disease. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press. 1995. ISBN 80-967366-1-2.
- ^ Delves et al. 2006,第4页
- ^ 77.0 77.1 Sompayrac 2008,第18页
- ^ Linderkamp O, Ruef P, Brenner B, Gulbins E, Lang F; Ruef; Brenner; Gulbins; Lang. Passive deformability of mature, immature, and active neutrophils in healthy and septicemic neonates. Pediatr. Res. 1998-12, 44 (6): 946–50 [2014-12-19]. PMID 9853933. doi:10.1203/00006450-199812000-00021. (原始内容存档于2012-04-28).
- ^ Paoletti, Notario & Ricevuti 1997,第62页
- ^
Soehnlein O, Kenne E, Rotzius P, Eriksson EE, Lindbom L; Kenne; Rotzius; Eriksson; Lindbom. Neutrophil secretion products regulate anti-bacterial activity in monocytes and macrophages. Clin. Exp. Immunol. 2008-01, 151 (1): 139–45. PMC 2276935
 . PMID 17991288. doi:10.1111/j.1365-2249.2007.03532.x.
. PMID 17991288. doi:10.1111/j.1365-2249.2007.03532.x.
- ^ Soehnlein O, Kai-Larsen Y, Frithiof R, et al. Neutrophil primary granule proteins HBP and HNP1-3 boost bacterial phagocytosis by human and murine macrophages. J. Clin. Invest. 2008-10, 118 (10): 3491–502. PMC 2532980
 . PMID 18787642. doi:10.1172/JCI35740.
. PMID 18787642. doi:10.1172/JCI35740.
- ^ Steinman RM, Cohn ZA; Cohn. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J. Exp. Med. 1973, 137 (5): 1142–62. PMC 2139237
 . PMID 4573839. doi:10.1084/jem.137.5.1142.
. PMID 4573839. doi:10.1084/jem.137.5.1142.
- ^ 83.0 83.1 Steinman, Ralph. Dendritic Cells. The Rockefeller University. [2014-12-19]. (原始内容存档于2009-06-27).
- ^ Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S; Valladeau; Zitvogel; Théry; Amigorena. Antigen presentation and T cell stimulation by dendritic cells. Annu. Rev. Immunol. 2002, 20: 621–67 [2014-12-19]. PMID 11861614. doi:10.1146/annurev.immunol.20.100301.064828.
- ^ Hoffbrand, Pettit & Moss 2005,第134页
- ^ Sallusto F, Lanzavecchia A; Lanzavecchia. The instructive role of dendritic cells on T-cell responses. Arthritis Res. 2002,. 4 Suppl 3 (Suppl 3): S127–32. PMC 3240143
 . PMID 12110131. doi:10.1186/ar567.
. PMID 12110131. doi:10.1186/ar567.
- ^ Sompayrac 2008,第42–46页
- ^ Novak, Natalija; Bieber, Thomas; Peng, Wen-Ming. The immunoglobulin E-Toll-like receptor network. International Archives of Allergy and Immunology. 2010-01-01, 151 (1): 1–7 [2016-12-12]. ISSN 1423-0097. PMID 19672091. doi:10.1159/000232565. (原始内容存档于2016-12-20).
- ^ Kalesnikoff J, Galli SJ; Galli. New developments in mast cell biology. Nature Immunology. 2008-11, 9 (11): 1215–23. PMC 2856637
 . PMID 18936782. doi:10.1038/ni.f.216.
. PMID 18936782. doi:10.1038/ni.f.216.
- ^ 90.0 90.1 Malaviya R, Abraham SN; Abraham. Mast cell modulation of immune responses to bacteria. Immunol. Rev. 2001-02, 179: 16–24. PMID 11292019. doi:10.1034/j.1600-065X.2001.790102.x.
- ^ Connell I, Agace W, Klemm P, Schembri M, Mărild S, Svanborg C; Agace; Klemm; Schembri; Mărild; Svanborg. Type 1 fimbrial expression enhances Escherichia coli virulence for the urinary tract. Proc. Natl. Acad. Sci. U.S.A. 1996-09, 93 (18): 9827–32 [2014-12-19]. PMC 38514
 . PMID 8790416. doi:10.1073/pnas.93.18.9827. (原始内容存档于2020-06-09).
. PMID 8790416. doi:10.1073/pnas.93.18.9827. (原始内容存档于2020-06-09).
- ^ Malaviya R, Twesten NJ, Ross EA, Abraham SN, Pfeifer JD; Twesten; Ross; Abraham; Pfeifer. Mast cells process bacterial Ags through a phagocytic route for class I MHC presentation to T cells. J. Immunol. 1996-02, 156 (4): 1490–96 [2014-12-19]. PMID 8568252.
- ^ Taylor ML, Metcalfe DD; Metcalfe. Mast cells in allergy and host defense. Allergy Asthma Proc. 2001, 22 (3): 115–19 [2014-12-19]. PMID 11424870. doi:10.2500/108854101778148764.
- ^ 94.0 94.1 Paoletti, Notario & Ricevuti 1997,第427页
- ^ Birge RB, Ucker DS; Ucker. Innate apoptotic immunity: the calming touch of death. Cell Death Differ. 2008-07, 15 (7): 1096–1102. PMID 18451871. doi:10.1038/cdd.2008.58.
- ^ Couzinet S, Cejas E, Schittny J, Deplazes P, Weber R, Zimmerli S; Cejas; Schittny; Deplazes; Weber; Zimmerli. Phagocytic uptake of Encephalitozoon cuniculi by nonprofessional phagocytes. Infect. Immun. 2000-12, 68 (12): 6939–45 [2014-12-19]. PMC 97802
 . PMID 11083817. doi:10.1128/IAI.68.12.6939-6945.2000. (原始内容存档于2020-06-08).
. PMID 11083817. doi:10.1128/IAI.68.12.6939-6945.2000. (原始内容存档于2020-06-08).
- ^ Segal G, Lee W, Arora PD, McKee M, Downey G, McCulloch CA; Lee; Arora; McKee; Downey; McCulloch. Involvement of actin filaments and integrins in the binding step in collagen phagocytosis by human fibroblasts. Journal of Cell Science. 2001-01, 114 (Pt 1): 119–129. PMID 11112696.
- ^ Rabinovitch M. Professional and non-professional phagocytes: an introduction. Trends Cell Biol. 1995-03, 5 (3): 85–87 [2014-12-19]. PMID 14732160. doi:10.1016/S0962-8924(00)88955-2. (原始内容存档于2019-03-04).
- ^ 99.0 99.1 99.2 99.3 99.4 Todar, Kenneth. Mechanisms of Bacterial Pathogenicity: Bacterial Defense Against Phagocytes. 2008. [2014-12-19]. (原始内容存档于2014-12-08).
- ^ Alexander J, Satoskar AR, Russell DG; Satoskar; Russell. Leishmania species: models of intracellular parasitism. J. Cell. Sci. 1999-09, 112 (18): 2993–3002 [2014-12-19]. PMID 10462516. doi:10.1242/jcs.112.18.2993. (原始内容存档于2023-02-21).
- ^ Celli J, Finlay BB; Finlay. Bacterial avoidance of phagocytosis. Trends Microbiol. 2002-05, 10 (5): 232–37. PMID 11973157. doi:10.1016/S0966-842X(02)02343-0.
- ^ Valenick LV, Hsia HC, Schwarzbauer JE; Hsia; Schwarzbauer. Fibronectin fragmentation promotes alpha4beta1 integrin-mediated contraction of a fibrin-fibronectin provisional matrix. Experimental Cell Research. 2005-09, 309 (1): 48–55. PMID 15992798. doi:10.1016/j.yexcr.2005.05.024.
- ^ Burns SM, Hull SI; Hull. Loss of resistance to ingestion and phagocytic killing by O(-) and K(-) mutants of a uropathogenic Escherichia coli O75:K5 strain. Infect. Immun. 1999-08, 67 (8): 3757–62 [2014-12-19]. PMC 96650
 . PMID 10417134.
. PMID 10417134.
- ^ Vuong C, Kocianova S, Voyich JM, et al. A crucial role for exopolysaccharide modification in bacterial biofilm formation, immune evasion, and virulence. J. Biol. Chem. 2004-12, 279 (52): 54881–86 [2014-12-19]. PMID 15501828. doi:10.1074/jbc.M411374200. (原始内容存档于2023-02-21).
- ^ Melin M, Jarva H, Siira L, Meri S, Käyhty H, Väkeväinen M; Jarva; Siira; Meri; Käyhty; Väkeväinen. Streptococcus pneumoniae capsular serotype 19F is more resistant to C3 deposition and less sensitive to opsonophagocytosis than serotype 6B. Infect. Immun. 2009-02, 77 (2): 676–84 [2014-12-19]. PMC 2632042
 . PMID 19047408. doi:10.1128/IAI.01186-08.
. PMID 19047408. doi:10.1128/IAI.01186-08.
- ^ 106.0 106.1 Foster TJ. Immune evasion by staphylococci. Nat. Rev. Microbiol. 2005-12, 3 (12): 948–58. PMID 16322743. doi:10.1038/nrmicro1289.
- ^ Sansonetti P. Phagocytosis of bacterial pathogens: implications in the host response. Semin. Immunol. 2001-12, 13 (6): 381–90. PMID 11708894. doi:10.1006/smim.2001.0335.
- ^ Dersch P, Isberg RR; Isberg. A region of the Yersinia pseudotuberculosis invasin protein enhances integrin-mediated uptake into mammalian cells and promotes self-association. EMBO J. 1999-03, 18 (5): 1199–1213. PMC 1171211
 . PMID 10064587. doi:10.1093/emboj/18.5.1199.
. PMID 10064587. doi:10.1093/emboj/18.5.1199.
- ^ Antoine JC, Prina E, Lang T, Courret N; Prina; Lang; Courret. The biogenesis and properties of the parasitophorous vacuoles that harbour Leishmania in murine macrophages. Trends Microbiol. 1998-10, 6 (10): 392–401. PMID 9807783. doi:10.1016/S0966-842X(98)01324-9.
- ^ Das D, Saha SS, Bishayi B; Saha; Bishayi. Intracellular survival of Staphylococcus aureus: correlating production of catalase and superoxide dismutase with levels of inflammatory cytokines. Inflamm. Res. 2008-07, 57 (7): 340–49. PMID 18607538. doi:10.1007/s00011-007-7206-z.
- ^ Hara H, Kawamura I, Nomura T, Tominaga T, Tsuchiya K, Mitsuyama M; Kawamura; Nomura; Tominaga; Tsuchiya; Mitsuyama. Cytolysin-dependent escape of the bacterium from the phagosome is required but not sufficient for induction of the Th1 immune response against Listeria monocytogenes infection: distinct role of Listeriolysin O determined by cytolysin gene replacement. Infect. Immun. 2007-08, 75 (8): 3791–3801 [2014-12-19]. PMC 1951982
 . PMID 17517863. doi:10.1128/IAI.01779-06.
. PMID 17517863. doi:10.1128/IAI.01779-06.
- ^ Datta V, Myskowski SM, Kwinn LA, Chiem DN, Varki N, Kansal RG, Kotb M, Nizet V; Myskowski; Kwinn; Chiem; Varki; Kansal; Kotb; Nizet. Mutational analysis of the group A streptococcal operon encoding streptolysin S and its virulence role in invasive infection. Mol. Microbiol. 2005-05, 56 (3): 681–95. PMID 15819624. doi:10.1111/j.1365-2958.2005.04583.x.
- ^ Iwatsuki K, Yamasaki O, Morizane S, Oono T; Yamasaki; Morizane; Oono. Staphylococcal cutaneous infections: invasion, evasion and aggression. J. Dermatol. Sci. 2006-06, 42 (3): 203–14. PMID 16679003. doi:10.1016/j.jdermsci.2006.03.011.
- ^ 114.0 114.1 Denkers EY, Butcher BA; Butcher. Sabotage and exploitation in macrophages parasitized by intracellular protozoans. Trends Parasitol. 2005-01, 21 (1): 35–41 [2014-12-19]. PMID 15639739. doi:10.1016/j.pt.2004.10.004. (原始内容存档于2020-09-24).
- ^ Gregory DJ, Olivier M; Olivier. Subversion of host cell signalling by the protozoan parasite Leishmania. Parasitology. 2005,. 130 Suppl: S27–35 [2014-12-19]. PMID 16281989. doi:10.1017/S0031182005008139.
- ^ Paoletti pp. 426–30
- ^ Heinzelmann M, Mercer-Jones MA, Passmore JC; Mercer-Jones; Passmore. Neutrophils and renal failure. Am. J. Kidney Dis. 1999-08, 34 (2): 384–99. PMID 10430993. doi:10.1016/S0272-6386(99)70375-6.
- ^ Lee WL, Downey GP; Downey. Neutrophil activation and acute lung injury. Curr Opin Crit Care. 2001-02, 7 (1): 1–7. PMID 11373504. doi:10.1097/00075198-200102000-00001.
- ^ 119.0 119.1 Moraes TJ, Zurawska JH, Downey GP; Zurawska; Downey. Neutrophil granule contents in the pathogenesis of lung injury. Curr. Opin. Hematol. 2006-01, 13 (1): 21–27. PMID 16319683. doi:10.1097/01.moh.0000190113.31027.d5.
- ^ Abraham E. Neutrophils and acute lung injury. Crit. Care Med. 2003-04, 31 (4 Suppl): S195–99. PMID 12682440. doi:10.1097/01.CCM.0000057843.47705.E8.
- ^ Ricevuti G. Host tissue damage by phagocytes. Ann. N. Y. Acad. Sci. 1997-12, 832: 426–48. PMID 9704069. doi:10.1111/j.1749-6632.1997.tb46269.x.
- ^ Charley B, Riffault S, Van Reeth K; Riffault; Van Reeth. Porcine innate and adaptative immune responses to influenza and coronavirus infections. Ann. N. Y. Acad. Sci. 2006-10, 1081: 130–36. PMID 17135502. doi:10.1196/annals.1373.014.
- ^ Sompayrac 2008,第1页
- ^ 124.0 124.1 Cosson P, Soldati T; Soldati. Eat, kill or die: when amoeba meets bacteria. Curr. Opin. Microbiol. 2008-06, 11 (3): 271–76 [2014-12-19]. PMID 18550419. doi:10.1016/j.mib.2008.05.005. (原始内容存档于2020-07-24).
- ^ Bozzaro S, Bucci C, Steinert M; Bucci; Steinert. Phagocytosis and host-pathogen interactions in Dictyostelium with a look at macrophages. Int Rev Cell Mol Biol. International Review of Cell and Molecular Biology. 2008, 271: 253–300 [2014-12-19]. ISBN 9780123747280. PMID 19081545. doi:10.1016/S1937-6448(08)01206-9. (原始内容存档于2020-09-24).
- ^ Chen G, Zhuchenko O, Kuspa A; Zhuchenko; Kuspa. Immune-like phagocyte activity in the social amoeba. Science. 2007-08, 317 (5838): 678–81 [2014-12-19]. PMC 3291017
 . PMID 17673666. doi:10.1126/science.1143991.
. PMID 17673666. doi:10.1126/science.1143991.
- ^ Delves et al. 2006,第251–252页
- ^ Hanington PC, Tam J, Katzenback BA, Hitchen SJ, Barreda DR, Belosevic M; Tam; Katzenback; Hitchen; Barreda; Belosevic. Development of macrophages of cyprinid fish. Dev. Comp. Immunol. 2009-04, 33 (4): 411–29 [2014-12-19]. PMID 19063916. doi:10.1016/j.dci.2008.11.004. (原始内容存档于2020-07-24).
来源
[编辑]- Delves, P. J.; Martin, S. J.; Burton, D. R.; Roit, I. M. Roitt's Essential Immunology 11th. Malden, MA: Blackwell Publishing. 2006. ISBN 1-4051-3603-0.
- Ernst, J. D.; Stendahl, O. (编). Phagocytosis of Bacteria and Bacterial Pathogenicity. New York: Cambridge University Press. 2006 [2009-08-19]. ISBN 0-521-84569-6. (原始内容存档于2020-04-13).
- Hoffbrand, A. V.; Pettit, J. E.; Moss, P. A. H. Essential Haematology 4th. London: Blackwell Science. 2005. ISBN 0-632-05153-1.
- Paoletti, R.; Notario, A.; Ricevuti, G. (编). Phagocytes: Biology, Physiology, Pathology, and Pharmacotherapeutics. New York: The New York Academy of Sciences. 1997. ISBN 1-57331-102-2.
- Robinson, J. P.; Babcock, G. F. (编). Phagocyte Function — A guide for research and clinical evaluation. New York: Wiley–Liss. 1998. ISBN 0-471-12364-1.
- Sompayrac, L. How the Immune System Works 3rd. Malden, MA: Blackwell Publishing. 2008. ISBN 978-1-4051-6221-0.
外部链接
[编辑]| 关于吞噬细胞 的图书馆资源 |
