十羰基二锰
| 十羰基二锰 | |
|---|---|
| |
| |
| IUPAC名 bis(pentacarbonylmanganese)(Mn—Mn) | |
| 别名 | Manganese carbonyl Decacarbonyldimanganese |
| 识别 | |
| CAS号 | 10170-69-1 |
| PubChem | 517769 |
| ChemSpider | 451751 |
| InChI |
|
| InChIKey | QFEOTYVTTQCYAZ-UHFFFAOYAD |
| RTECS | GG0300000 |
| 性质 | |
| 化学式 | C10O10Mn2 |
| 摩尔质量 | 389.98 g·mol⁻¹ |
| 外观 | 黄色晶体 |
| 密度 | 1.750 g/cm3 |
| 熔点 | 154 °C |
| 沸点 | 60 °C (0.5 mm Hg) 升华 |
| 溶解性(水) | 不溶 |
| 结构 | |
| 偶极矩 | 0 D |
| 危险性 | |
| 警示术语 | R:23/24/25 |
| 安全术语 | S:22-26-36/37/39-45 |
| 主要危害 | 释放出一氧化碳 |
| 相关物质 | |
| 相关化合物 | Co2(CO)8 Fe3(CO)12 Fe2(CO)9 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
十羰基二锰,分子式为Mn2(CO)10,它在有机金属化学中是一种重要的锰试剂[1]。
合成方法
[编辑]最初合成十羰基二锰是通过在一氧化碳气氛中用金属锰还原碘化锰来实现的,但这个方法的产率不高[2]。更高效的一种合成方法是在200大气压的一氧化碳气氛中用二苯甲醇自由基 (Ph2CO·-Na+,benzophenone ketyl)还原无水氯化锰制得十羰基二锰[3]。十羰基二锰也可以从廉价的甲基环戊二烯基三羰基锰(methylcyclopentadienyl manganese tricarbonyl, MMT)合成得到[4]。
分子结构
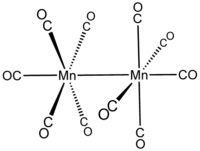
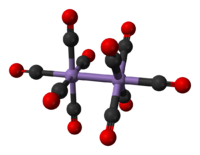
[编辑]十羰基二锰的分子结构中只有端基配位的羰基配体,不存在桥基羰基配体。它的分子结构可以用(CO)5Mn-Mn(CO)5来描述,分子中有两种化学环境的CO:一种是两个CO配体处于与Mn-Mn键(Mn-Mn键键长297pm)同轴的位置分别于一个锰原子配位;另一种是余下的八个CO配体,呈两个处在两个垂直于Mn-Mn键的平面上的平面正方形,各与两个锰原子配位。分子结构属于少见的D4d点群对称结构。[5]
反应和用途
[编辑]十羰基二锰是一种能在空气中稳定存在的晶状固体,但是它在溶液中容易发生氧化,溶液需要在舒伦克线(Schlenk line)上进行操作[6]。它可被某些碱金属单质还原同时成盐,生成符合18电子规则的Mn(CO)5-阴离子:
Mn2(CO)10 + 2 Na → 2 Na[Mn(CO)5]
Mn(CO)5-阴离子可与多种亲电试剂发生反应:可被质子化生成[HMn(CO)5],也可被甲基化生成[(CH3)Mn(CO)5]
十羰基二锰也可与卤素反应,发生Mn-Mn键的断裂,比如它与单质溴的反应:
Mn2(CO)10 + Br2 → 2[Mn(CO)5Br]
由于十羰基二锰在加热或光照下可分解成两个不稳定的五羰基锰自由基(Mn(CO)5·),因此可用作自由基聚合引发剂参与单体的自由基聚合[7][8]

安全性
[编辑]十羰基二锰是一种具有挥发性的金属羰基原子簇合物。
参考资料
[编辑]- ^ Elschenbroich, C. "Organometallics" (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ Brimm, E. O.; Lynch, M. A.; Sesny, W. J. "Preparation and Properties of Manganese Carbonyl" Journal of the American Chemical Society 1954, volume 76, page 3831 - 3835. doi:10.1021/ja01643a071
- ^ King, R. B. Organometallic Syntheses. Volume 1 Transition-Metal Compounds; Academic Press: New York, 1965. ISBN 0-444-42607-8
- ^ King, R. B.; Stokes, J. C.; Korenowski, T. F. "A Convenient Synthesis of Dimanganese Decarbonyl from Inexpensive Starting Materials at Atmospheric Pressure" Journal of Organometallic Chemistry 1968, volume 11, Pages 641-643.http://dx.doi.org/10.1016/0022-328X(68)80099-3
- ^ L. F. Dahl, E. Ishishi, R. E. Rundle "Polynuclear Metal Carbonyls. I. Structures of Mn2(CO)10 and Re2(CO)10 J. Chem. Phys. 1957, volume 26, p. 1750. doi:10.1063/1.1743615
- ^ Pauson, P. L. "Decacarbonyldimanganese" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289
- ^ A. D. Asandei, O. I. Adebolu, C. P. Simpson "Mild-Temperature Mn2(CO)10-Photomediated Controlled Radical Polymerization of Vinylidene Fluoride and Synthesis of Well-Defined Poly(vinylidene fluoride) Block Copolymers" J. Am. Chem. Soc., 2012, volume 134, p 6080–6083 doi:10.1021/ja300178r
- ^ K. Koumura, K. Satoh, M. Kamigaito "Manganese-Based Controlled/Living Radical Polymerization of Vinyl Acetate, Methyl Acrylate, and Styrene: Highly Active, Versatile, and Photoresponsive Systems" Macromolecules, 2008, volume 41, p 7359–7367. doi:10.1021/ma801151s
