叔丁基氯
外觀
| 叔丁基氯 | |||
|---|---|---|---|
| |||
| IUPAC名 2-氯-2-甲基丙烷 | |||
| 別名 | 見內文 | ||
| 識別 | |||
| CAS號 | 507-20-0 | ||
| PubChem | 10486 | ||
| ChemSpider | 10054 | ||
| SMILES |
| ||
| InChI |
| ||
| UN編號 | 1127 | ||
| EINECS | 208-066-4 | ||
| RTECS | TX5040000 | ||
| 性質 | |||
| 化學式 | C4H9Cl | ||
| 摩爾質量 | 92.57 g·mol⁻¹ | ||
| 外觀 | 無色液體 | ||
| 密度 | 0.89 g cm−3 | ||
| 熔點 | −26 ℃ | ||
| 沸點 | 51 ℃ | ||
| 蒸氣壓 | 34.9 kPa (20 ℃) | ||
| 危險性 | |||
| 警示術語 | R:R12, R36/37/38 | ||
| 安全術語 | S:S7, S9, S16, S29, S33 | ||
| 歐盟分類 | |||
| NFPA 704 | |||
| 閃點 | −9 ℃(開杯) −23 ℃(閉杯) | ||
| 自燃溫度 | 540 ℃ | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
叔丁基氯(IUPAC命名:2-甲基-2-氯丙烷)是一種有機化合物,在室溫下為無色的液體,分子式為C4H9Cl。
性質
[編輯]叔丁基氯微溶於水,在溶解過程中,有進行自發性溶劑解(水解)的趨勢。它有易燃性和揮發性,主要用途是作為起始分子進行親核取代反應,以合成從叔丁醇到叔丁醇鹽的一系列物質。
叔丁基氯溶於極性質子溶劑水時,C-Cl鍵容易極化,Cl−離去,生成穩定的叔丁基碳正離子,並與一個水分子反應形成叔丁醇,同時生成鹽酸。如果用更強的親核試劑來進行此反應,產物不一定為醇,而是其他含叔丁基的化合物。
其他名稱:叔丁氯、1,1-二甲基氯乙烷、1-氯-1,1-二甲基乙烷、2-氯異丁烷、2-甲基-2-氯丙烷、氯三甲基甲烷、三甲基氯甲烷、t-氯丁烷、tert-氯丁烷、t-BuCl、UN 1127。
製取
[編輯]實驗原理
[編輯]在實驗室中,叔丁基氯可通過叔丁醇與濃鹽酸的SN1 反應合成,如下圖所示。
| 第 一 步 |

|
酸使醇質子化,形成一個良好的離去基團(水)。 |
| 第 二 步 |
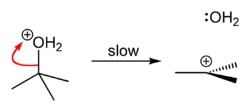
|
水從質子化的叔丁醇上離去,形成較穩定的三級碳正離子。 |
| 第 三 步 |

|
氯離子進攻碳正離子,生成叔丁基氯。 |
總反應為:
由於叔丁醇是三級醇,在第二步中生成的叔丁基碳正離子相對較穩定,使得後續反應遵循SN1機理,而伯醇則會遵循SN2機理。
實驗步驟
[編輯]- 將叔丁醇和濃鹽酸混合振盪 10~15 min 後轉移到分液漏斗中。
- 靜置待液體分層打開活塞放掉下層水相,然後往分液漏斗中加入去離子水洗滌,然後通過分液操作棄去下層水相。再往分液漏斗中加入 5% 的碳酸氫鈉溶液洗滌以除去殘留的鹽酸,棄去水相。最後往分液漏斗加入去離子水洗滌以除去殘留的碳酸氫鈉和氯化鈉,棄去水相。
- 取出有機相,加入適量無水氯化鈣作為乾燥劑,振盪至呈澄清狀態,說明已經乾燥完畢。
- 過濾掉氯化鈣後採用水浴加熱的方式將液體進行蒸餾,收集 50~51℃ 的餾分,接收瓶置於冰水浴中。[1]
注意事項
[編輯]- 在分液操作時應該將水層放淨,否則有機層中會混有水而影響後續的乾燥和蒸餾操作。
- 在用無水氯化鈣乾燥時不應加得太多,否則有機相會被氯化鈣吸附而導致產量降低。
- 蒸餾時必須採用水浴加熱而不能直接空氣浴加熱,因為叔丁基氯的沸點只有 51℃,接收瓶用冰水浴同樣是減弱了叔丁基氯的揮發。
參見
[編輯]參考資料
[編輯]- ^ 曾和平 (編). 有机化学实验(第四版) 2014年6月第4版. 北京: 高等教育出版社. 2014-06: 103. ISBN 978-7-04-039976-9.