p軌域
在化學與原子物理學中,p軌態(英語:p orbital)是一種原子軌態,其角量子數為1,其磁量子數可以為-1、0或+1,且每個殼層裏中有三個p軌態,Px、Py、Pz,形狀皆相同但方向不同,每個可以容納2個電子,因此,p軌態共可以容納6個電子。
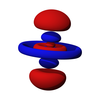
p軌態是一個很穩定的軌態,其穩定性僅次於s軌態,為能量第二低的軌態,另外由於能階交錯,若以週期的角度來看,p軌態是能量最高的軌態,也是最後填滿的軌態,其電子出現概率密度的形象是啞鈴形,呈線性對稱,換句話說,p軌態是一個雙啞鈴形或吊鐘形的軌態。
命名
[編輯]p軌態的「p」是「principal」,其為「主系光譜」之意。
結構
[編輯]

p軌態從第二個殼層開始出現,最小的p軌態是2p軌態,也就是說,當主量子數n=1時,沒有p軌態(1p軌態不存在)。當角量子數l=1時,磁量子數m會有三種值,分別為1、0、-1,因此,自量子數n=2開始有三種p軌態對應於每一個主量子數,例如,當主量子數n=2時,p軌態分別為2px、2py和2pz軌態,每個軌態皆可分成兩葉,帶有不同的「正負性」,這是代表波函數量值的正負。大小則如同s軌態,p軌態的形狀在2p、3p、4p裏都相同,只是大小隨着主量子數的增加而增加。p軌態同樣存在波節面,如3p軌態在主要電子出現的兩葉中,有較小而與主葉分離的區域,此處電子出現概率為0,則這個區域即為p軌態的波節面,隨着主量子數的增加,波節的數量也會跟着增加。
電子波
[編輯]三個p軌態的原子軌態角量子數ℓ=1。p軌態的三次諧波的表示法:
with
| pz | px | py |
|---|---|---|
 |
 |

|
p軌態
[編輯]在週期表中,每個週期元素的價殼層,p軌態是最後才填滿的軌態,直至18族,p軌態是全滿的。
p區元素
[編輯]p區元素是指元素週期表中13族至18族的元素(氦除外)。這些元素其新增加的電子皆填入p軌態,故稱該區塊為p區。週期表中從第2週期開始的每個週期都各有6個p區元素。
參見
[編輯]參考文獻
[編輯]- 曾國輝《原子結構》建宏出版社 台北市 1999 ISBN 957-724-801-2