化學計量
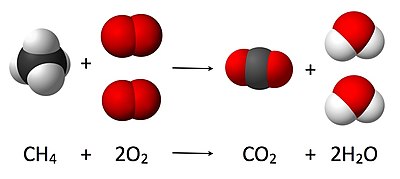
化學計量[1](stoichiometry)是化學反應中各物質量的相互關係,即反應物和生成物在化學反應前、反應中和反應後的量之間的關係。化學計量數[2](stoichiometric number)則是化學反應方程式中各物質的係數,是化合物彼此反應的比例關係或數量,即各反應物或生成物前的數值。
例如,圖中為甲烷在空氣中完全燃燒的方程式,方程式中、前的數值(或「係數」)2就是它的化學計量數。當一個物質前的數值為1時,便省略不寫,如式中的和。
將一個未加化學計量數的方程補充化學計量數,使其符合物質、電荷守恆的過程叫做化學反應方程式的配平。
化學計量比
[編輯]化學反應方程式中,各反應物的化學計量之比稱為化學計量比(stoichiometric ratio)。如果一個化學反應按照化學計量比發生,我們有如下假設:[3]
- 所有反應物都完全反應
- 反應物不缺少
- 反應物不過量
一些反應可以按照化學計量比進行反應,如溶液中的離子反應,有一些則需要其中的一種或多種反應物過量,如物質的燃燒。例如,對於反應:
- (沉澱反應)
- (中和反應)
無論哪一個反應物過量,都可以按照化學計量比進行;而對於
在氧氣過量的情況下,碳燃燒生成二氧化碳,而氧氣不足的時候,則有一氧化碳生成。[4]
對於一些反應,可以人為的控制化學計量比,來獲得不同化合物,尤其是一些二元化合物。如紅磷和鈷化合,根據不同的化學計量比,可以產生、和:[5]
化學反應中化學計量的特殊情況
[編輯]燃料的燃燒
[編輯]燃料在燃燒時,為確保反應完全,需要氧化劑過量。若空氣作為氧化劑,則使燃料完全燃燒所需的空氣與燃料之比成為空燃比。常見燃料的空燃比如下:
| 燃料 | 質量比[6] | 體積比[7] | 質量比百分數 |
|---|---|---|---|
| 汽油 | 14.7 : 1 | — | 6.8% |
| 天然氣 | 17.2 : 1 | 9.7 : 1 | 5.8% |
| 丙烷 | 15.67 : 1 | 23.9 : 1 | 6.45% |
| 乙醇 | 9 : 1 | — | 11.1% |
| 甲醇 | 6.47 : 1 | — | 15.6% |
| 正丁醇 | 11.2 : 1 | — | 8.2% |
| 氫氣 | 34.3 : 1 | 2.39 : 1 | 2.9% |
| 柴油 | 14.5 : 1 | — | 6.8% |
| 甲烷 | 17.19 : 1 | 9.52 : 1 | 5.5% |
和物量無關的反應
[編輯]有一些反應進行的方式和物量無關,而和反應物的濃度有關,改變反應物的濃度,生成物的種類也隨之改變,如銅和硝酸的氧化還原反應:
- Cu + 4 HNO3(濃) → Cu(NO3)2 + 2 NO2↑ + 2 H2O
- 3 Cu + 8 HNO3(稀) → 3 Cu(NO3)2 + 2 NO↑ + 4 H2O
在10mol·L-1以上的硝酸中,按上式反應;而在4.8mol·L-1時,按下式反應。此時,無論硝酸或者銅是否過量,反應都按照硝酸的濃度進行,而和其物量無關。[8]類似地,對於硝酸鐵溶液和銀的反應,反應如何進行與硝酸鐵溶液的濃度有關,低濃度時,硝酸鐵水解產生的H3O+與NO3-和Ag反應;而高濃度的硝酸鐵則存在Fe3+氧化Ag和NO3-(H+)氧化Ag的競爭反應,通過理論計算,Fe3+在3.16mol·L-1以上便可氧化Ag。[9]
用途
[編輯]對於一個已配平的化學反應方程式,已知其中一個參與反應的物量(或其它已知量,如質量等),或者其中一個生成物的物量,便可求出反應方程式中其它物量,這廣泛用於分析化學中的滴定、重量分析的計算中。[10]在物理化學中,如化學反應速率方程的求解與計算中,也能用到化學計量。[11]
而在物質的製備與合成中,往往需要將反應方程式中的化學計量比作為加料多少的參考;對於密閉空間有氣體產生的化學反應,也需要根據生成氣體的量來判斷反應是否安全。
參考文獻
[編輯]- ^ 存档副本. [2023-07-15]. (原始內容存檔於2023-07-15).
- ^ 存档副本. [2023-07-15]. (原始內容存檔於2023-07-15).
- ^ What’s in a Name? Amount of Substance, Chemical Amount, and Stoichiometric Amount Carmen J. Giunta Journal of Chemical Education 2016 93 (4), 583-586 doi:10.1021/acs.jchemed.5b00690
- ^ 武漢大學, 吉林大學 等. 無機化學(第三版)下冊. 高等教育出版社, 2011. pp 740. ISBN 978-7-04-004880
- ^ 項斯芬, 嚴宣申, 曹庭禮 等. 無機化學叢書 第四卷 氮 磷 砷分族. 科學出版社, 2011: pp 162. ISBN 978-7-03-030548-0
- ^ John B. Heywood: "Internal Combustion Engine Fundamentals page 915", 1988
- ^ North American Mfg. Co.: "North American Combustion Handbook", 1952
- ^ 羅宿星, 伍遠輝, 孫東來. 銅與硝酸反應實驗中硝酸濃稀界限的研究. 實驗室科學, 2012. 15(5): 67-69
- ^ 朱正德. 硝酸鐵溶液溶解銀鏡的理論分析與實驗探索. 化學教學, 2011(5): 78-79
- ^ 李璧玉. 淺議分析化學中的「化學計量數比」. 雲南師範大學學報(自然科學版), 2005. 25(1): 28-30
- ^ 潘一兵,張良軍. 速率方程與反應級數、化學計量數. 遼寧師專學報:自然科學版, 2001. 3(2): 17-18














