四氯化鉿
| 四氯化鉿 | |
|---|---|
| |
| IUPAC名 Hafnium(IV) chloride Hafnium tetrachloride | |
| 識別 | |
| CAS號 | 13499-05-3 |
| PubChem | 37715 |
| ChemSpider | 34591 |
| SMILES |
|
| InChI |
|
| InChIKey | PDPJQWYGJJBYLF-XBHQNQODAR |
| 性質 | |
| 化學式 | HfCl4 |
| 莫耳質量 | 320.302 g·mol⁻¹ |
| 外觀 | 白色結晶固體 |
| 密度 | 3.89 g/cm3[1] |
| 熔點 | 432 °C(705 K) |
| 溶解性(水) | 分解[2] |
| 蒸氣壓 | 1 mmHg(190 °C) |
| 結構 | |
| 晶體結構 | 單斜,mP10[1] |
| 空間群 | C2/c, No. 13 |
| 晶格常數 | a = 0.6327 nm, b = 0.7377 nm, c = 0.62 nm |
| 配位幾何 | 4 |
| 危險性 | |
| MSDS | MSDS |
| 歐盟編號 | 未列明 |
| 主要危害 | 刺激性和腐蝕性 |
| 閃點 | 不燃 |
| 相關物質 | |
| 其他陰離子 | 四氟化鉿 四溴化鉿 四碘化鉿 |
| 其他陽離子 | 四氯化鈦 四氯化鋯 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
四氯化鉿,無機化合物,化學式HfCl4。這種無色固體是大多數有機鉿化合物的前體。它可用於多種特定用途,主要集中於材料科學中,或作為催化劑。
製備
[編輯]可以用幾種相近的方法來製備HfCl4:
- HfO2 + 2 CCl4 → HfCl4 + 2 COCl2
- HfO2 + 2 Cl2 + C → HfCl4 + CO2
- HfC+2 Cl2→HfCl4+C
分離鋯和鉿
[編輯]鉿和鋯通常共生於礦物中,如鋯石、曲晶石和斜鋯石。二氧化鉿(HfO2)的含量在鋯石中為0.05%至2.0%,曲晶石為5.5%至17%,斜鋯石為1.0%至1.8%[8]。鉿和鋯的化合物會從礦石中一併提取,並轉化為四氯化物的混合物。
HfCl4和ZrCl4難以分離,因為鉿和鋯的化合物具有非常相似的化學和物理性質。它們的原子半徑相近:鉿為156.4 pm,而鋯為160 pm[9]。兩種金屬的反應相似,並會形成相似的配合物。
許多方法可從ZrCl4中提煉出HfCl4,包括分餾、分級沉澱、分級結晶和離子交換法。固體氯化鉿的蒸氣壓(從476至681 K)的對數(以10為底數)由下式給出:log10(P) = -5197/T + 11.712,其中壓力的單位為托,溫度的單位為開爾文。(熔點下的壓力為23000托。)[10]
有一種方法基於兩種四鹵化物還原性的差異[8]。選擇性地將鋯化合物還原一至二價,甚至是單質,可以分離四鹵化物。在還原反應中,四氯化鉿基本不反應,並且可從直接從鋯的低鹵化物中回收。四氯化鉿是揮發性的,因此可以很容易地從不揮發的三鹵化鋯中分離出來。
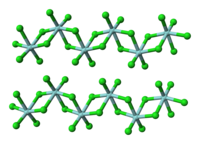
結構及成鍵
[編輯]此鹵化物含有+4氧化態的鉿。固體HfCl4是八面體鉿中心聚合物。每個鉿中心周圍有六個氯配體,二個為終端,四個橋接至另一個鉿中心。在氣相中,ZrCl4和HfCl4有著與TiCl4相同的單體四面體結構[11]。氣相HfCl4的電子成相研究顯示,Me-Cl核間距為2.33 Å,Cl…Cl核間距為3.80 Å。核間距比r(Me-Cl)/r(Cl…Cl)為1.630,與正四面體模型的預測值(1.633)很接近[9]。
反應特性
[編輯]該化合物極易水解,並釋放氯化氫:
- HfCl4 + H2O → HfOCl2 + 2 HCl
因而,久置的樣品中常常混有氯氧化物,它也是無色的。
- HfCl4 + 2 OC4H8 → HfCl4(OC4H8)2
因為此配合物可溶於有機溶劑,它是一種製備鉿的其他配合物的有用試劑。
與醇形成醇鹽。
- HfCl4 + 4 ROH → Hf(OR)4 + 4 HCl
這些化合物結構複雜。
還原
[編輯]HfCl4極難還原。在膦配位體的存在下,可以用鈉鉀合金還原[13]:
- 2 HfCl4 + 2 K + 4 P(C2H5)3 → Hf2Cl6[P(C2H5)3]4 + 2 KCl
深綠色的二鉿產物是抗磁性的。X射線晶體學結果表明該配合物的結構為共邊雙八面體,與鋯類似物非常類似。
用途
[編輯]四氯化鉿是高活性的齊格勒-納塔催化劑的前體,用於烯烴,特別是丙烯的聚合中[14]。典型的催化劑由四苄基鉿衍生而來。
在各種有機合成應用中,HfCl4是一種高效的路易斯酸。例如,相比使用氯化鋁,用四氯化鉿能使二烯丙基氯矽烷更高效地烷基化二茂鐵。大尺寸的Hf可以減小HfCl4與二茂鐵配合的傾向。[15]
HfCl4可以加速1,3-偶極環加成,並對其加以控制[16]。與芳基和脂族醛肟一起使用時,相比其它路易斯酸,能得到更好的結果,並可生產外異構體。
微電子應用
[編輯]HfCl4曾作為化學氣相沉積和原子層沉積的一種前體,以生成二氧化鉿和矽酸鉿,它們在製造現代高密度集成電路時用作高κ電介質[17]。然而,由於其相對較低的揮發性和腐蝕性的副產物(即HCl),HfCl4為金屬有機前體所淘汰,例如四(乙基甲基氨基)鉿(TEMAH)[18]。
參考
[編輯]- ^ 1.0 1.1 Niewa R., Jacobs H. (1995) Z. Kristallogr. 210: 687
- ^ Haynes, William M. CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data 92nd. Boca Raton, FL.: CRC Press. 2011: 4.66. ISBN 978-1-4398-5511-9. OCLC 730008390 (英語).
- ^ Kirk-Othmer Encyclopedia of Chemical Technology 11 4th. 1991.
- ^ Hummers, W. S.; Tyree, S. Y.; Yolles, Seymour; Basolo, F.; Bauer, L. Zirconium and Hafnium Tetrachlorides. Inorganic Syntheses. Hoboken, NJ, USA: John Wiley & Sons, Inc. 2007-01-05: 121–126. ISBN 978-0-470-13235-7. ISSN 1934-4716. doi:10.1002/9780470132357.ch41.
- ^ Hopkins, B. S. 13 Hafnium. Chapters in the chemistry of less familiar elements. Stipes Publishing. 1939: 7.
- ^ Hála, Jiri. Halides, oxyhalides and salts of halogen complexes of titanium, zirconium, hafnium, vanadium, niobium and tantalum 40 1st. Oxford: Pergamon. 1989: 176 – 177. ISBN 0080362397.
- ^ Elinson, S. V. and Petrov, K. I. (1969) Analytical Chemistry of the Elements: Zirconium and Hafnium. 11.
- ^ 8.0 8.1 Newnham, Ivan Edgar "Purification of Hafnium Tetrachloride". 美國專利第2,961,293號 November 22, 1960.
- ^ 9.0 9.1 Spiridonov, V. P.; Akishin, P. A.; Tsirel'nikov, V. I. Electronographic investigation of the structure of zirconium and hafnium tetrachloride molecules in the gas phase. Journal of Structural Chemistry (Springer Nature). 1962, 3 (3): 311–312. ISSN 0022-4766. doi:10.1007/bf01151485.
- ^ Palko, A. A.; Ryon, A. D.; Kuhn, D. W. The Vapor Pressures of Zirconium Tetrachloride and Hafnium Tetrachloride. The Journal of Physical Chemistry (American Chemical Society (ACS)). 1958, 62 (3): 319–322. ISSN 0022-3654. doi:10.1021/j150561a017.
- ^ Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016: 964–966. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英語).
- ^ Manzer, L. E. Tetrahydrofuran Complexes of Selected Early Transition Metals. Inorg. Synth. Inorganic Syntheses. 1982, 21. ISBN 978-0-470-13252-4. doi:10.1002/9780470132524.ch31.
- ^ Riehl, M. E.; Wilson, S. R.; Girolami, G. S. Synthesis, X-ray Crystal Structure, and Phosphine-Exchange Reactions of the Hafnium(III)-Hafnium(III) Dimer Hf2Cl6[P(C2H5)3]4. Inorg. Chem. 1993, 32 (2): 218–222. doi:10.1021/ic00054a017.
- ^ Ron Dagani. Combinatorial Materials: Finding Catalysts Faster. Chemical and Engineering News. 2003-04-07: 10 [2015-04-05]. (原始內容存檔於2006-06-23).
- ^ Ahn, Samyoung; Song, Young-Sang; Yoo, Bok Ryul; Jung, Il Nam. Lewis Acid-Catalyzed Friedel−Crafts Alkylation of Ferrocene with Allylchlorosilanes. Organometallics (American Chemical Society (ACS)). 2000, 19 (14): 2777–2780. ISSN 0276-7333. doi:10.1021/om0000865.
- ^ Graham, Alison B.; Grigg, Ronald; Dunn, Peter J.; Higginson, Paul. Tandem 1,3-azaprotiocyclotransfer–cycloaddition reactions between aldoximes and divinyl ketone. Remarkable rate enhancement and control of cycloaddition regiochemistry by hafnium(iv) chloride. Chemical Communications (Royal Society of Chemistry (RSC)). 2000, (20): 2035–2036. ISSN 1359-7345. doi:10.1039/b005389i.
- ^ Choi, J.H.; Mao, Y.; Chang, J.P. Development of hafnium based high-k materials—A review. Materials Science and Engineering: R: Reports (Elsevier BV). 2011, 72 (6): 97–136. ISSN 0927-796X. doi:10.1016/j.mser.2010.12.001.
- ^ Robertson, John. High dielectric constant gate oxides for metal oxide Si transistors. Reports on Progress in Physics (IOP Publishing). 2005-12-14, 69 (2): 327–396. ISSN 0034-4885. doi:10.1088/0034-4885/69/2/r02.
擴展閱讀
[編輯]- Duraj, S. A.; Towns; Baker; Schupp, J. Structure of cis-Tetrachlorobis(tetrahydrofuran)hafnium(IV). Acta Crystallographica. 1990, C46 (5): 890–2. doi:10.1107/S010827018901382X.
