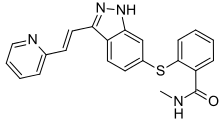
阿昔替尼
 | |
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Inlyta(英立达) |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a612017 |
| 核准狀況 | |
| 懷孕分級 |
|
| 给药途径 | 口服给药 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 |
|
| 藥物動力學數據 | |
| 生物利用度 | 58%[1] |
| 血漿蛋白結合率 | >99%[1] |
| 药物代谢 | 肝脏(主要由CYP3A4/CYP3A5代谢,同时能与CYP1A2、CYP2C19和UGT1A1结合)[1] |
| 生物半衰期 | 2.5-6.1小时[1] |
| 排泄途徑 | 粪便(41%;其中12%为原形药物)、尿液(23%)[1] |
| 识别信息 | |
| |
| CAS号 | 319460-85-0 |
| PubChem CID | |
| IUPHAR/BPS | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| PDB配體ID | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.166.384 |
| 化学信息 | |
| 化学式 | C22H18N4OS |
| 摩尔质量 | 386.469 g/mol |
| 3D模型(JSmol) | |
| |
| |
阿昔替尼(Axitinib,研发代号AG013736,商品名Inlyta,中文商品名英立达)是一种小分子酪氨酸激酶抑制剂,由辉瑞研发。 在动物(异种移植)模型中,它能显著抑制乳腺癌的生长[2];在肾细胞癌(RCC)[3]和其他几种肿瘤类型的临床试验中,它显示出部分疗效。[4]尽管有致命的不良反应报道,但该药物在无进展生存期有所增加后被FDA批准用于治疗肾细胞癌。[5][6]
临床应用
[编辑]肾细胞癌
[编辑]截至2016年,该药已获得FDA(2012年1月27日)、EMA(2012年9月13日)、英国MHRA(2012年9月3日)、澳大利亚TGA(2012年7月26日)和NMPA(2015年4月)批准用于肾细胞癌的治疗。 [7][8][9][10]
临床试验
[编辑]一项II期临床试验显示阿昔替尼与吉西他滨联合化疗对晚期胰腺癌有良好的疗效。[11] 然而,根据辉瑞公司于2009年1月30日实验报告,在III期临床试验中,该药与吉西他滨联用治疗晚期胰腺癌时未显示出比单独使用吉西他滨具有更高的存活率,因此该试验暂停。 [12]
2010年,一项III期临床试验表明,阿昔替尼用于治疗转移性肾细胞癌 (mRCC)时相比索拉非尼显示无进展生存期显著延长。[13]基于上述实验结果,2011年12月, 美国肿瘤药物咨询委员会(ODAC)一致投票建议FDA批准阿昔替尼用于晚期肾细胞癌(RCC)的二线治疗。 [14]
2015年发表的一项研究表明[15],阿昔替尼能有效抑制一种突变基因(BCR-ABL1[T315I])。该基因在慢性粒细胞白血病和成人急性淋巴细胞白血病中很常见,这些突变基因已对其他酪氨酸激酶抑制剂(如伊马替尼)产生了耐药性。 这是通过使用患者细胞筛选已知药物发现现有药物的新适应症的第一个例子。
禁忌症
[编辑]对阿西替尼过敏的患者禁用阿昔替尼。 [10]
具有下列疾病的患者应慎用该药或减少用药剂量:
- 高血压
- 血栓栓塞(静脉和动脉)
- 脑出血
- 胃肠穿孔
- 甲状腺功能异常(包括甲亢和甲减),建议先用阿昔替尼治疗,然后再定期测量甲状腺功能。
- 大型外科手术前24小时应停止治疗。
- 蛋白尿,建议在治疗期间定期监测蛋白尿。
- 肝功能不全,建议在治疗期间定期监测肝功能。
不良反应
[编辑]20%以上患者会产生腹泻、高血压、疲劳、食欲下降、恶心、发声障碍、体重下降、呕吐、乏力和便秘等常见副作用。 [16]
药物相互作用
[编辑]应尽可能避免阿昔替尼与CYP3A4/CYP3A5抑制剂合用,因为它们可能会降低阿昔替尼的血浆清除率。
作用机理
[编辑]阿昔替尼能抑制血管内皮生长因子受体(VEGFR)1-3、c-KIT和PDGFR,从而抑制肿瘤组织的血管生成。 [17]
也有相关研究表明它可能像其他一些酪氨酸激酶抑制剂(如索拉非尼)一样,通过诱导自噬发挥作用 。 [18]
该药也能与BCR-ABL融合蛋白结合(与VEGF结合不同的构象),特别是该药还能抑制具有耐药性的BCR-ABL[T315I]突变体同工型。[15]
| 蛋白 | IC50(nM) |
|---|---|
| VEGFR1 | 0.1 |
| VEGFR2 | 0.2 |
| VEGFR3 | 0.1-0.3 |
| PDGFR | 1.6 |
| C-KIT | 1.7 |
药代动力学
[编辑]| 生物利用度 | 达峰浓度 | 血浆峰浓度 | AUC | 表观分布容积 | 血浆蛋白结合率 | 药物代谢酶 | 消除半衰期 | 排泄途径 |
|---|---|---|---|---|---|---|---|---|
| 58% | 2.5-4.1小时 | 27.8ng/mL | 265ng·h/mL | 160L | > 99% | 主要是CYP3A4和CYP3A5 。 CYP1A2 , CYP2C19 , UGT1A1的贡献较小 | 2.5-6.1小时 | 粪便(41%),尿液(23%) |
参考文献
[编辑]- ^ 1.0 1.1 1.2 1.3 1.4 Inlyta (axitinib) dosing, indications, interactions, adverse effects, and more. Medscape Reference. WebMD. [25 January 2014]. (原始内容存档于2018-07-05).
- ^ Wilmes, LJ; Pallavicini, MG; Fleming, LM; Gibbs, J; Wang, D; Li, KL; Partridge, SC; Henry, RG; Shalinsky, DR. AG-013736, a novel inhibitor of VEGF receptor tyrosine kinases, inhibits breast cancer growth and decreases vascular permeability as detected by dynamic contrast-enhanced magnetic resonance imaging. Magnetic Resonance Imaging. April 2007, 25 (3): 319–27. PMID 17371720. doi:10.1016/j.mri.2006.09.041.
- ^ Rini, B; Rixe, O; Bukowski, R; Michaelson, MD; Wilding, G; Hudes, G; Bolte, O; Steinfeldt, H; Reich, SD. AG-013736, a multi-target tyrosine kinase receptor inhibitor, demonstrates anti-tumor activity in a Phase 2 study of cytokine-refractory, metastatic renal cell cancer (RCC). Journal of Clinical Oncology ASCO Annual Meeting Proceedings. June 2005, 23 (16S): 4509. (原始内容存档于2014-01-26).
- ^ Rugo, HS; Herbst, RS; Liu, G; Park, JW; Kies, MS; Steinfeldt, HM; Pithavala, YK; Reich, SD; Freddo, JL. Phase I trial of the oral antiangiogenesis agent AG-013736 in patients with advanced solid tumors: pharmacokinetic and clinical results. Journal of Clinical Oncology. August 2005, 23 (24): 5474–83. PMID 16027439. doi:10.1200/JCO.2005.04.192.
- ^ FDA Approves Inlyta for Advanced Renal Cell Carcinoma. Drugs.com. January 27, 2012 [2019-09-23]. (原始内容存档于2016-09-18).
- ^ John Fauber; Elbert Chu. The Slippery Slope: Is a Surrogate Endpoint Evidence of Efficacy?. Milwaukee Journal Sentinel/MedPage Today. Oct 27, 2014 [2019-09-23]. (原始内容存档于2017-04-29).
- ^ INLYTA (axitinib) tablet, film coated [Pfizer Laboratories Div Pfizer Inc]. DailyMed. Pfizer Laboratories Div Pfizer Inc. September 2013 [25 January 2014]. (原始内容存档于2019-11-27).
- ^ Inlyta : EPAR - Product Information (PDF). European Medicines Agency. Pfizer Ltd. 17 December 2013 [25 January 2014]. (原始内容存档 (PDF)于2018-07-05).
- ^ Inlyta 1 mg 3mg, 5 mg & 7mg film-coated tablets - Summary of Product Characteristics (SPC). electronic Medicines Compendium. Pfizer Limited. 5 December 2013 [25 January 2014]. (原始内容存档于2014-02-22).
- ^ 10.0 10.1 PRODUCT INFORMATION INLYTA (axitinib) (PDF). TGA eBusiness Services. Pfizer Australia Pty Ltd. 5 July 2013 [25 January 2014]. (原始内容存档于2019-03-29).
- ^ Spano, JP; Chodkiewicz, C; Maurel, J; Wong, R; Wasan, H; Barone, C; Létourneau, R; Bajetta, E; Pithavala, Y. Efficacy of gemcitabine plus axitinib compared with gemcitabine alone in patients with advanced pancreatic cancer: an open-label randomised phase II study. Lancet. June 2008, 371 (9630): 2101–2108. PMID 18514303. doi:10.1016/S0140-6736(08)60661-3.
- ^ Pfizer pancreatic cancer drug fails, trial halted. Reuters. January 30, 2009 [2019-09-23]. (原始内容存档于2009-02-14).
- ^ Pfizer's Phase III Trial in mRCC Turns Up Positive Results. 19 Nov 2010 [2019-09-23]. (原始内容存档于2018-02-20).
- ^ ODAC Unanimously Supports Axitinib for Renal Cell Carcinoma. 7 Dec 2011 [2019-09-23]. (原始内容存档于2018-04-05).
- ^ 15.0 15.1 Tea Pemovska; Eric Johnson; Mika Kontro; Gretchen A. Repasky; Jeffrey Chen; Peter Wells; Ciarán N. Cronin; Michele McTigue; Olli Kallioniemi. Axitinib effectively inhibits BCR-ABL1(T315I) with a distinct binding conformation. Nature. 2015, 519 (7541): 102–105. PMID 25686603. doi:10.1038/nature14119.
- ^ FDA Prescribing Information (PDF). 30 Jan 2012 [2019-09-23]. (原始内容存档 (PDF)于2017-02-25).
- ^ Escudier, B; Gore, M. Axitinib for the Management of Metastatic Renal Cell Carcinoma. Drugs in R&D. 2011, 11 (2): 113–126. PMC 3585900
 . PMID 21679004. doi:10.2165/11591240-000000000-00000.
. PMID 21679004. doi:10.2165/11591240-000000000-00000.
- ^ Zhang Y. Screening of kinase inhibitors targeting BRAF for regulating autophagy based on kinase pathways.. J Mol Med Rep. Jan 2014, 9 (1): 83–90 [2019-09-23]. PMID 24213221. doi:10.3892/mmr.2013.1781. (原始内容存档于2018-09-20).
