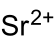溴酸鍶
外觀
| 溴酸鍶 | ||
|---|---|---|
|
| ||
| 英文名 | Strontium bromate | |
| 識別 | ||
| CAS號 | 14519-18-7 | |
| PubChem | 9819472 | |
| SMILES |
| |
| InChI |
| |
| EINECS | 238-531-7 | |
| 性質 | ||
| 化學式 | Br2O6Sr | |
| 摩爾質量 | 343.42 g·mol−1 | |
| 外觀 | 無色到微黃色的潮解晶體[1] | |
| 密度 | 3.773 g·cm−3[1](一水) | |
| 熔點 | 240 °C(分解)[1] | |
| 溶解性 | 373 g·l−1 (25 °C)[1] | |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | ||
溴酸鍶,化學式Sr(BrO3)2,是實驗室的或工廠中都很少考慮使用的化學品,但在奧利佛·薩克斯出版的《鎢絲舅舅》提到過它從飽和水溶液中析出結晶會變熱。[2]它對皮膚有刺激性,吸入或攝入它對身體有害。
製備
[編輯]性質
[編輯]
溴酸鍶易溶於水。1000 g的水在0 °C下能溶解183.2 g的溴酸鍶,在25 °C下為272.5 g,在104 °C下則為410 g。它通常以一水合物Sr(BrO3)2 · H2O的形式存在,一水合物在75.5 °C下失水。[4]
溴酸鍶等一水合物呈單斜晶系,空間群I2/c(No. 15),晶格參數 a = 8.8742 Å、b = 7.609 Å、c = 9.3748 Å、β = 91.27°。[5]它的晶體結構和溴酸鋇同構。[6]
參考資料
[編輯]- ^ 1.0 1.1 1.2 1.3 1.4 Dale L. Perry, Sidney L. Phillips: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 387 (溴酸鍶,第387頁,載於Google圖書).
- ^ Oliver Sacks. Uncle Tungsten: Memories of a Chemical Boyhood First Vintage Books. 2002: 230.
- ^ R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie. Verlag S. Hirzel, Bd. 2, 1908. S. 223 (Volltext).
- ^ Linke, William F. The Solubilities of the Strontium Halates. Journal of the American Chemical Society. 1953, 75 (23): 5797–5800. ISSN 0002-7863. doi:10.1021/ja01119a009.
- ^ Sastry, D. L.; Rajasekharan, M. V.; Rao, K. V. S. Rama. An X-ray study of strontium bromate monohydrate. Zeitschrift für Kristallographie. 1980, 152 (3-4): 333–334. ISSN 0044-2968. doi:10.1524/zkri.1980.152.3-4.333.
- ^ Templeton, L. K.; Templeton, D. H. Structure of barium bromate monohydrate. Acta Crystallographica Section C Crystal Structure Communications. 1989-04-15, 45 (4): 672–673. doi:10.1107/S0108270188013071.
- ^ C. Rammelsberg: Ueber die Bromsäure und deren Salze. In: Pogg. Ann. 1841, 52, S. 79–97 (Volltext (頁面存檔備份,存於互聯網檔案館)).