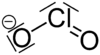
亞氯酸鈉
外觀
| 亞氯酸鈉 | |||
|---|---|---|---|
| |||
| |||

| |||
| IUPAC名 Sodium chlorite | |||
| 別名 | 氯(Ⅲ)酸鈉 | ||
| 識別 | |||
| CAS號 | 7758-19-2 49658-21-1(三水) | ||
| PubChem | 23668197 | ||
| ChemSpider | 22860 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | UKLNMMHNWFDKNT-REWHXWOFAT | ||
| UN編號 | 1496 | ||
| EINECS | 231-836-6 | ||
| ChEBI | 78667 | ||
| RTECS | VZ4800000 | ||
| KEGG | C19523 | ||
| 性質 | |||
| 化學式 | NaClO2 | ||
| 摩爾質量 | 90.44 g·mol⁻¹ | ||
| 外觀 | 白色固體 | ||
| 密度 | 2.5 g/cm3 (固) | ||
| 熔點 | 180–200 °C 分解 | ||
| 溶解性(水) | 39 g/100 ml (17 °C) | ||
| 危險性 | |||
| 歐盟分類 | 未列 | ||
| NFPA 704 | |||
| 閃點 | 不可燃 | ||
| 相關物質 | |||
| 其他陰離子 | 氯化鈉、次氯酸鈉 氯酸鈉、高氯酸鈉 | ||
| 其他陽離子 | 亞氯酸鉀、亞氯酸鋇 | ||
| 相關化學品 | 二氧化氯、亞氯酸 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
亞氯酸鈉是亞氯酸的鈉鹽,化學式為NaClO2,是一種白色或微帶黃綠色晶體,其水溶液呈黃綠色,與酸反應產生ClO₂氣體。用於造紙工業中。它具強氧化性,儲存時應當避免與有機物質及還原性物質接觸,以防止爆炸。
製取
[編輯]亞氯酸鈉以氯酸鈉(NaClO3)為原料製取:
- 用還原劑,如氯化鈉、二氧化硫或鹽酸,在強酸性環境下還原氯酸鈉,製取不穩定易爆炸的氣體二氧化氯(ClO2):
- 2NaClO3 + SO2 → 2ClO2 + Na2SO4
- 用鹼性溶液吸收二氧化氯,再用過氧化氫還原,就可以得到亞氯酸鈉:
- 2ClO2 + 2NaOH + H2O2 → 2NaClO2 + 2H2O + O2
化學性質
[編輯]- NaClO2 + NaClO → NaClO3 + NaCl
- 2 NaClO2 + Cl2 → 2 NaCl + 2ClO2
用途
[編輯]亞氯酸鈉主要用於製取二氧化氯氣體,對水質消毒。用二氧化氯處理過的水中不會產生有毒的三鹵甲烷。此外,亞氯酸鈉可用於對纖維、紙張、織物等的漂白。
有機合成中,亞氯酸鈉可將醛氧化為羧酸。類似的氧化劑還有氧化銀、重鉻酸吡啶鹽(PDC)和高錳酸鉀。
毒性
[編輯]亞氯酸鈉是一種強氧化劑,因此,可以引起正鐵血紅蛋白血症、溶血、腎衰竭。[2]
參考資料
[編輯]- ^ M. C. Taylor, J. F. Whitte, G. P. Vincent, G. I. Cunnigham. SODIUM CHLORITE PROPERTIES AND REACTIONS. Ind. Eng. Chem., 1940, 32 (7), pp 899–903 DOI: 10.1021/ie50367a007
- ^ Goldfrank's Toxicologic Emergencies, McGraw-Hill Professional; 8th edition (March 28, 2006), ISBN 978-0-07-143763-9
- "Chemistry of the Elements", N.N. Greenwood and A. Earnshaw, Pergamon Press, 1984.
- "Kirk-Othmer Concise Encyclopedia of Chemistry", Martin Grayson, Editor, John Wiley & Sons, Inc., 1985