氫鍵

 氫鍵是分子間作用力的一種,是一種永久偶極之間的作用力,氫鍵發生在已經以共價鍵與其它原子鍵結合的氫原子與另一個原子之間(X-H…Y),通常發生氫鍵作用的氫原子兩邊的原子(X、Y)都是電負性較強的原子。氫鍵既可以是分子間氫鍵,也可以是分子內的[1]。其鍵能最大約為200kJ/mol,一般為5-30kJ/mol,比一般的共價鍵、離子鍵和金屬鍵鍵能要小,但強於靜電引力。
氫鍵是分子間作用力的一種,是一種永久偶極之間的作用力,氫鍵發生在已經以共價鍵與其它原子鍵結合的氫原子與另一個原子之間(X-H…Y),通常發生氫鍵作用的氫原子兩邊的原子(X、Y)都是電負性較強的原子。氫鍵既可以是分子間氫鍵,也可以是分子內的[1]。其鍵能最大約為200kJ/mol,一般為5-30kJ/mol,比一般的共價鍵、離子鍵和金屬鍵鍵能要小,但強於靜電引力。
氫鍵對於生物高分子具有尤其重要的意義,它是蛋白質和核酸的二、三和四級結構得以穩定的部分原因。
成鍵
[編輯]氫鍵通常可用X-H…Y來表示。其中X以共價鍵與氫相連,具有較高的電負性,可以穩定負電荷,因此氫易解離,具有酸性(質子給予體)。而Y則具有較高的電子密度,一般是含有孤電子對的原子,容易吸引氫原子,從而與X和H原子形成三中心四電子鍵。
鍵能
[編輯]氫鍵鍵能大多在25-40kJ/mol之間。一般認為鍵能小於25kJ/mol的氫鍵屬於較弱氫鍵,鍵能在25-40kJ/mol的屬於中等強度氫鍵,而鍵能大於40kJ/mol的氫鍵則是較強氫鍵。[2] 曾經有一度認為最強的氫鍵是[HF2]−中的FH…F−鍵,計算出的鍵能大約為169kJ/mol。[3] 而事實上,用相同方法計算甲酸和氟離子間的[HCO2H…F−]氫鍵鍵能,結果要比HF2−的高出大約30kJ/mol。[4]
| 較弱 | 中等 | 較強 | |||
|---|---|---|---|---|---|
| HSH…SH2 NCH…NCH H2NH…NH3 MeOH…OHMe HOH…OH2 |
7 16 17 19 22 |
FH…FH ClH…OMe2 FH…OH2 |
29 30 38 |
HOH…Cl− HCONH2…OCHNH2 HCOOH…OCHOH HOH…F− H2OH+…OH2 FH…F− HCO2H…F− |
55 59 59 98 151 169 ~200 |
常見氫鍵的平均鍵能數據為:
- F—H :F (155 kJ/mol 或 40 kcal/mol)
- O—H :N (29 kJ/mol 或 6.9 kcal/mol)
- O—H :O (21 kJ/mol 或 5.0 kcal/mol)
- N—H :N (13 kJ/mol 或 3.1 kcal/mol)
- N—H :O (8 kJ/mol 或 1.9 kcal/mol)
- HO—H :OH3+ (18 kJ/mol[5] 或 4.3 kcal/mol)
成鍵原子
[編輯]典型的氫鍵中,X和Y是電負性很強的F、N和O原子。但C、S、Cl、P甚至Br和I原子在某些情況下也能形成氫鍵[2],但通常鍵能較低。
碳在與數個電負性強的原子相連時也有可能產生氫鍵。例如在氯仿CHCl3中,碳原子直接與三個氯原子相連,氯原子周圍電子雲密度較大,因而氫原子周圍即帶有部分正電荷,碳也因此參與了氫鍵的形成,扮演了質子供體的角色。
芳香環、碳碳三鍵或雙鍵在某些情況下都可作為電子供體,與強極性的X-H(如-O-H)形成氫鍵。
方向
[編輯]X-H…Y往往不是嚴格的直線。[6] 哪怕不算分叉的氫鍵,一對一的氫鍵中也有很多鍵角處在150°-180°之間的情況,氟化氫長鏈中的氫鍵即是一例。[2]
對稱氫鍵
[編輯]通常氫是通過共價鍵與X原子相連,並通過較長和較弱的「氫鏈」與Y原子連接,即使X與Y是相同的元素,X-H和H…Y距離也往往不相等。但在M+HA2−型的酸式鹽中,其中A是F−或某些有機酸(如乙酸和苯甲酸),氫原子恰好處於X和Y原子的中心(X-H…Y)。這一類例子被稱作對稱氫鍵,它們往往鍵能較大,鍵長較短。[7]
對稱氫鍵和不對稱氫鍵的現象往往難以解釋。一個比較認同的解釋是,將FHF−離子中的氫鍵看成氫橋,類似於乙硼烷中的BHB硼橋鍵。只不過硼橋鍵是三中心兩電子鍵,而氫橋鍵是三中心四電子鍵。[7]
雙氫鍵
[編輯]1995年以來,報道了許多種分子間存在一種被稱為雙氫鍵的新型分子間力,可用通式AH…HB表示。[8] 雙氫鍵的鍵長一般小於220pm,極限可能為270pm,鍵能從n~n*10kJ/mol不等,相當於傳統分子間力能量數量級。雙氫鍵的一些例子包括:BH4−…HCN、BH4−…CH4、LiH…NH4、LiH…HCN、LiH…HC≡CH,CH4…H-NH3+和H-Be-H…H-NH3等,其中以BH4−…HCN雙氫鍵的鍵長為最短(171pm),鍵能也最高(75.44kJ/mol),遠大於水和HF間的氫鍵鍵能。目前對雙氫鍵的研究還不是很深入。
分子間氫鍵
[編輯]
- 醇、酚、羧酸、胺、酰胺、醣類均常有。
- 常形成二聚體或聚合物,尤其在低極性溶液或蒸氣狀態時。例如:乙酸二聚體、氟化氫鏈狀聚合物與環狀六聚體。
- 常形成空洞結構降低固態密度。例如:冰中每個水分子都按四面體方向參與4個O-H…O氫鍵,平均每分子二氫鍵,鍵能18.8kJ/mol。水分子在晶體結構中空間佔有率較低,存在六邊形空洞,故冰的密度較小。熔化時破壞部分氫鍵,熔化熱5.0kJ/mol,故剛熔化的水中仍有大量的氫鍵,並隨溫度增高更多氫鍵斷裂,使密度增大。在4℃時,受熱使分子間距增大造成密度減小的趨勢與受熱使氫鍵斷裂造成密度增加的趨勢相等,因此此時水密度最大。這個溫度對於水中生物至關重要,它保證了冬季時水中生物不至於因為水結冰而死亡。
- 常增加表面張力,分子間氫鍵形成彈性薄膜。例如水。
- 常增加比熱,因為受熱時氫鍵吸收能量斷裂。例如水。
- 常增加摩爾汽化熱與沸點,因汽化須破壞氫鍵。例如:
- PH3<AsH3<NH3<SbH3<BiH3,NH3有氫鍵故沸點上升(惟氫鍵較弱),其餘依分子量。
- H2S<H2Se<H2Te<H2O,H2O有氫鍵故沸點上升,其餘依分子量。
- HCl<HBr<HI<HF,HF有氫鍵故沸點上升,其餘依分子量。
- 常增加摩爾熔化熱與熔點,但增加量常較沸點小,因為熔化僅須打破部分氫鍵以破壞晶格。另外,熔點受晶體堆積方式等影響,較難以預測。
- 常增加在極性溶劑中的溶解度(同類互溶),尤其在也有氫鍵的溶劑中,因為溶質與溶劑間氫鍵與偶極-偶極力。例如:氨、氟化氫在水中的高溶解度。
- 結晶水合物中存在由氫鍵構建的類冰骨架,其中可裝入小分子或離子。例如:甲烷水合物。
分子內氫鍵
[編輯]- 通常,形成分子內氫鍵後,須圍成五、六或七員環,才是穩定的結構,故分子內氫鍵多發生於順式或鄰位。如順丁烯二酸、鄰苯二酚、鄰羥基苯甲醛(水楊醛)、鄰羥基苯甲酸(水楊酸)。
- 常使酸性增強,因為分子內氫鍵促進了未參與氫鍵的氫自氫鍵的受體上離解。例如:苯甲酸的pKa=11.02;鄰羥基苯甲酸(水楊酸)可形成一個分子內氫鍵,pKa=11;2,6-二羥基苯甲酸(γ-間羥基苯甲酸)可形成兩個分子內氫鍵,pKa=8.3。
- 常使熔沸點降低,因與其他分子間作用力減小。例如:鄰苯二酚、鄰氯苯酚、鄰硝基苯酚的沸點均較間位與對位者低。
- 加熱時常被破壞。
- 常增加耐酸鹼性,因質子化或去質子化須破壞分子內氫鍵。
- 可能造成一種異構體優於另一種。例如:反丁烯二酸較具有分子內氫鍵的順丁烯二酸位能更低而更穩定、2,4-戊二酮的烯醇形式(有分子內氫鍵)與酮形式(無分子內氫鍵)分別在氣相與極性液體中更優。[來源請求]
- 常增加在極性溶劑中的溶解度,尤其也有氫鍵的溶劑,因為:
- 常增加黏度。例如:甘油(丙三醇)和硫酸有較高的黏度、丙三醇黏度>乙二醇黏度>乙醇黏度。
- 常見於,羥基的H,與苯環上鄰位,或順式鏈(包含無分順反的鏈)同側上(包含無分側之可旋轉單鍵上)的羰基(包含酮基、羧基、醛基等中的羰基)、硝基或另一羥基的O,或鹵取代基(通常是氟),形成氫鍵。例如:順丁烯二酸(順式羧基H-羧基O)、2-羥基苯甲酸(鄰位羥基H-羧基O)、2-羥基苯甲醛(鄰位羥基H-醛基O)、2-氟苯甲酸(鄰位羧基H-氟取代基)、1,2-苯二酚(鄰位羥基H-羥基O)、2-硝基苯酚(鄰位羥基H-硝基N)、丙二酸(可旋轉鏈羧基H-羧基O)、2-羥基苯乙酮(鄰位羥基H-酮基O)。
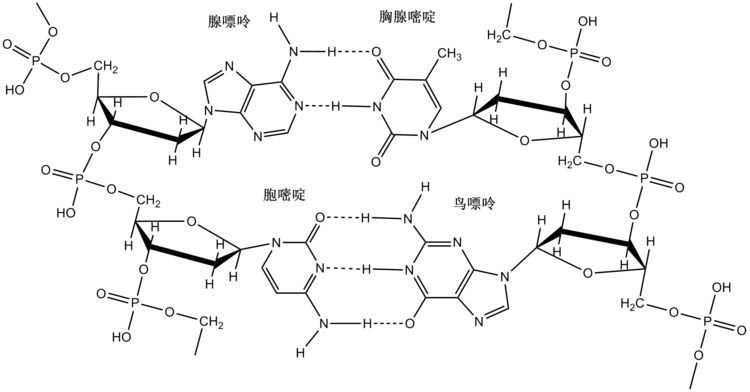
- 常形成聚合物,並常為螺旋狀。例如:C=O…H-N氫鍵使蛋白質形成α螺旋、DNA或RNA的兩條鏈的含氮鹼基通過氫鍵配對,而氫鍵的飽和性和方向性使得雙螺旋的鹼基配對具有專一性,即A-T靠2個氫鍵配對而C-G靠3個氫鍵配對。
參見
[編輯]參考資料
[編輯]- ^ International Union of Pure and Applied Chemistry. "hydrogen bond (頁面存檔備份,存於互聯網檔案館)". Compendium of Chemical Terminology Internet edition.
- ^ 2.0 2.1 2.2 2.3 Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements, 2nd Ed., Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ 對於這個數據有爭議,一般在150-250kJ/mol之間。不少人認為155kJ/mol較恰當,參見 Emsley, J. (1980). "Very Strong Hydrogen Bonds". Chemical Society Reviews 9: 91-124. 離子迴旋共振譜法得出的數據為163±4kJ/mol,參看 J. Emsley, Polyhedron 4, 489-90 (1985).也與之吻合較好。
- ^ J. Emsley, O. P. A. Hoyte and R. E. Overill, J. Chem. Soc., Chem. Commun., 225 (1977).
- ^ Omer Markovitch and Noam Agmon (2007). "Structure and energetics of the hydronium hydration shells". J. Phys. Chem. A 111 (12): 2253 - 2256. doi:10.1021/jp068960g.
- ^ F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo, and Manfred Bochmann, Advanced Inorganic Chemistry, 6th ed.. Wiley-Interscience. ISBN 0-471-19957-5.
- ^ 7.0 7.1 張青蓮等。《無機化學叢書》第一卷。北京:科學出版社。
- ^ Chem. Commun., 1996, 14: 1633.
- ^ PubChem. 2-Butenedioic acid. pubchem.ncbi.nlm.nih.gov. [2024-05-11]. (原始內容存檔於2024-06-10) (英語).
外部連結
[編輯]




