四氯化铂
外观
| 四氯化铂 | |
|---|---|

| |
| 英文名 | Platinum(IV) chloride Platinum tetrachloride |
| 别名 | 氯化铂(IV) |
| 识别 | |
| CAS号 | 13454-96-1 |
| PubChem | 26031 |
| ChemSpider | 19957150 |
| SMILES |
|
| InChI |
|
| InChIKey | KBPRWZWTZAMEIF-XBHQNQODAX |
| 性质 | |
| 化学式 | PtCl4 |
| 摩尔质量 | 336.89 g/mol g·mol⁻¹ |
| 外观 | 棕红色粉末 |
| 密度 | 4.303 g/cm3(无水) 2.43 g/cm3(五水) |
| 熔点 | 370 °C(643 K)(分解) |
| 溶解性(水) | 58.7 g/100 mL(无水) 易溶(五水) |
| 溶解性 | 可溶于丙酮,微溶于乙醇,难溶于乙醚(无水) 可溶于乙醇、乙醚(五水) |
| 磁化率 | −93.0·10−6 cm3/mol |
| 结构 | |
| 分子构型 | Square planar |
| 危险性 | |
| 欧盟分类 | 未列出 |
| 致死量或浓度: | |
LD50(中位剂量)
|
276 mg/kg (rat, oral) |
| 相关物质 | |
| 其他阴离子 | 四氟化铂 四溴化铂 四碘化铂 |
| 其他阳离子 | 四氯化铱 |
| 相关化学品 | 二氯化铂 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
四氯化铂是一种无机化合物,化学式为PtCl4,为棕色固体,其中铂为+4价。[1]
结构
[编辑]和典型的Pt(IV)化合物一样,四氯化铂的金属中心采用八面体配位{PtCl6}。该几何构型通过形成其中一半的氯桥配体在铂中心之间桥接的聚合物来实现。其聚合物的结构仅在溶解时会破坏氯桥配体。因此,加入HCl得到H2PtCl6。顺式的PtCl4L2的Pt(IV)的路易斯碱加合物是已知的,大多数通过氧化Pt(II)的衍生物来制备。
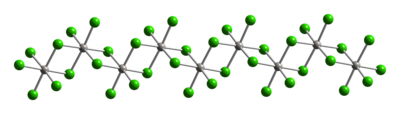 |
制备与化学性质
[编辑]PtCl4可从氯铂酸的热分解制备,而氯铂酸由王水溶解金属铂得到:
- Pt + 4 HNO3 + 6 HCl → H2PtCl6 + 4 NO2 + 4 H2O
- H2PtCl6 → PtCl4 + 2 HCl↑
当过量的酸去除后,PtCl4从水溶液中结晶出大量的红色的五水合物晶体PtCl4·5H2O,[2]它在300℃的干燥氯气流中加热可以脱水。PtCl4·5H2O是其最稳定的形式,也是市售品的常见形式。
PtCl4和可溶性碱反应,可以得到[Pt(OH)6]2−。甲基格氏试剂与其作用,伴随着部分水解,PtCl4转化为立方簇[Pt(CH3)3(OH)]4。[3]加热PtCl4,释放出氯,生成二氯化铂:
- PtCl4 → PtCl2 + Cl2↑
铂的四溴化物和四碘化物都是已知的。
参考文献
[编辑]- ^ Cotton, S. A. Chemistry of Precious Metals, Chapman and Hall (London): 1997. ISBN 0-7514-0413-6.
- ^ George Samuel Newth. A text-book of inorganic chemistry. Longmans, Green, and co. 1920: 694 [2017-07-01]. (原始内容存档于2019-08-15).
- ^ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
拓展阅读
[编辑]- 胡建华. 一种光谱纯四氯化铂的制备方法[P]. CN102030378A
