钍
所有已知的钍同位素皆不穏定,最稳定的232Th的半衰期长达140亿年,与宇宙年龄相当。它缓慢地经由α衰变开始名为钍衰变系的衰变链,最终止于稳定的208Pb。由于具有寿命极长的同位素,钍和铀及铋是宇宙及地球中唯三存量尚高的原始放射性元素。[a]此外,钍也是地球上储量最丰富的放射性元素,估计其在地壳中的丰度为铀的三倍多,生产来源主要是独居石砂中提取稀土元素的副产物。
挪威业余矿物学家Morten Thrane Esmark在1829年发现了钍,瑞典化学家永斯·贝吉里斯在鉴定后,以北欧神话中的雷神索尔(Thor)命名。钍在十九世纪末开始有所应用,而其放射性在1900年代被广为认知。在二十世纪后半因担忧钍的放射性,其许多用途皆被取代。
钍是钨极气体保护电弧焊中,电极里的合金元素,但其使用逐渐被取代。钍也被应用在科学仪器中高阶光学元件,以及煤气灯的气罩,但这些用量都很小。由于储量充裕,有人建议用钍取代铀作为核反应堆的燃料,已有数个钍反应炉被建造。
整体性质
[编辑]钍的硬度一般,具顺磁性,为亮银色的放射性金属元素。在周期表中,位于锕之右,镤之左,铈之下。纯钍的延展性相当好, 与一般金属一样,可被冷轧、挤锻及拉制。[4]在室温下,钍金属为面心立方堆积,它有其它两种形态,一个在高温(超过1360 °C,体心立方堆积),一个在高压(约100 GPa,体心四方堆积)。[4]
钍金属的体积模数(一种物质有多难压缩的度量)为54 GPa,与锡约同(58.2 GPa)。铝为(75.2 GPa),铜为137.8 GPa,软钢(低碳钢)则为160–169 GPa。[5]钍的硬度与软钢差不多,所以加热后可被滚成薄板及拉制成线。[6]
钍的密度约为铀及钚的一半,但硬度比二者高。[6]温度在1.4 K以下时会变成超导体。[4]钍的熔点为1,750 °C,比锕(1,227 °C)及镤都来得高(1,568 °C)。在第七周期前段,从钫到钍,熔点逐渐上升(与其它周期相同),这是因为原子中的非定域电子数目从钫的一颗增加到钍的四颗,这导致金属的电荷从+1增加到+4,而电子与金属离子的吸引力也因此上升。在钍之后直到钚,熔点开始下降,f电子的数目也从0.4左右增加到6左右,这是因为5f轨域及6d轨域混成比例增加,在更复杂的晶体结构中形成了有方向的化学键而弱化了金属键。[6][7](钍之中的f电子数目并非整数,因为5f及6d之间有重叠)[7]在锕系元素里,在锎之前并可在毫克等级下做分析的元素中,钍则具有最高的熔点沸点,以及第二低的密度,只有锕比钍轻。钍的沸点为4,788 °C,在所有已知沸点的元素中是第五高。[b]
钍的性质会因样品中杂质含量的不同而有大幅变化,主要的杂质通常是二氧化钍(ThO2),即使是最纯的钍样品,通常也含有大约千分之一的氧化物。[4]实验测量出的密度界于11.5及11.66 g/cm3之间,略小于理论预测值11.7 g/cm3,这也许是因为在制成金属时形成了微观空洞。[4]这些值位于隔邻的锕(10.1 g/cm3)及镤(15.4 g/cm3)之间,也符合锕系前段元素的趋势。[4]
钍可与许多金属形成合金。加入少量的钍可以增加镁的机械强度,钍铝合金被认为是一种在未来钍核反应堆来储存钍的方法。钍与铬及铀形成共熔混合物,并与较轻的同族元素铈在液态及固态都完全互溶。[4]
化学性质
[编辑]钍原子有90个电子,其中四个电子为价电子。理论上价电子有三个原子轨域可以填:5f、6d及7s。[9]尽管钍位于周期表中的f区块,它的基态有着异常的[Rn]6d27s2电子排布。5f及6d子壳层在早期锕系元素中能量相当接近,甚至比镧系元素中的4f和5d子壳层还近,而钍的6d子壳层比5f子壳层能量低,因为它的5f子壳层并未被完全填满的6s及6p子壳层良好遮蔽,所以较不稳定。这是因为相对论效应,更精确的说是自旋-轨道作用,在周期表底部变得更为重要。钍原子的5f、6d及7s的能量相近,导致钍几乎总会失去它的四个价电子,并处于它的最高可能氧化态+4。这和钍的同族镧系元素铈不同,铈的最高氧化态也是+4,但是+3氧化态更为重要也更为稳定。比起铈,钍的游离能和氧化还原电位更像是过渡金属锆及铪,所以钍的化学性质也是像锆及铪。这种类似于过渡金属的性质是前半段锕系元素的通性。[10][11]
Th4+: __ / O2−: __
虽然气态钍原子有着异常的电子排布,5f在钍金属里扮演了重要角色。这首先在1995年被认识到,如果钍的电子排布是[Rn]6d27s2,且5f轨域在费米能阶之上,那么钍的晶体结构会像是4族元素钛、锆及铪一样,是六方最密堆积,而不是实际上的面心立方堆积。只有在考虑5f之后,才能解释真实的晶体结构。钍的+3氧化态的电子排布[Rn]5f1,5f在其稀有和极不稳定的扮演的角色也很清楚。[12]
四价钍化合物的颜色通常是无色或是黄色,像是银或铅一样,因为Th4+也没有5f或是6d电子。[6]所以钍的化学内容,大部分是易带正电的金属,形成了一个反磁性的且有稳定惰性气体排布的离子,这暗示了钍及s区块主族元素的相似性。[13][c]钍和铀是最常被探讨的放射性元素,因为它们的放射性足够低,不需要特别处理。[14]
反应性
[编辑]钍的反应性极高,而且是易带正电的金属。Th4+/Th的标准还原电位为−1.90 V,钍的电正度比锆及铝更高。[15]切成细块的钍金属会自燃。[4]当在空气中被加热时,钍屑会被点燃,焰色为亮白光并产生二氧化钍。块状纯钍与空气的反应则相对缓慢,虽然在数月后有可能发生腐蚀现象。大多的钍样品都含有不同程度的二氧化钍,而加快了腐蚀过程。[4]这些样品会逐渐失去光泽,表面变灰最后变成黑色。[4]
在标准状况下,钍会逐渐被水侵蚀,但不会快速溶于大多常见的酸中,除了氢氯酸以外,钍会溶于其中,并留下黑色的不可溶残留物ThO(OH,Cl)H。[4][16]钍会溶于含有少量氟离子或氟硅酸的浓硝酸中,[4][17]若不含这两者,则会像铀、钚一样被硝酸钝化。[4][18][19]

Th4+: __ / F−: __
无机化合物
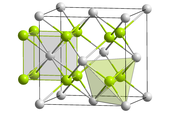
[编辑]大多钍与非金属的二元化合物,可用加热混合物的方式制备。[20]在空气中,钍会燃烧形成ThO2,晶体结构为萤石结构。[21]二氧化钍是耐火材料,在所有氧化物中具有最高的熔点(3390 °C)。[22] 它会潮解,并会与水与许多气体快速反应,[23]并易溶于含氟离子的浓硝酸中。[24]
当加热时,二氧化钍会放出强蓝光,与其较轻的同族化合物二氧化铈混合时,光会变成白色。这是过去钍最常见的应用,也就是被用于煤气网罩的原理。[23]此效果不需要火焰,在1901年,人们发现Welsbach煤气网罩(由ThO2和1% CeO2组成),在暴露在冷的未燃气体[哪个/哪些?]与空气之中时,会维持在全光状态。[25]二氧化钍发出光的波长,比同温下的白炽物发出的黑体辐射短,此现象称作为强热发光。这是因为二氧化钍与铈在火焰中的高浓度自由基的重新结合中扮演着催化剂的角色,这个结合会放出大量能量。1%的二氧化铈的加入,加强了可见光区的发射率。此外铈不像钍,它可以处于多个氧化态,它的价数及可见光的发射率会与火焰的发生区域有关(区域不同,化学组成不同,价数也不同)。[25]已发现数个钍与氧族(硫、硒及碲)的化合物,以及与氧族(硫、硒及碲)及氧结合的化合物。[26]
所有四种四卤化钍化合物都存在,也有一些低价数的溴化物及碘化物。[27]四卤化合物都是八配位并都可潮解,易溶于像是水的极性溶剂。[28]许多相关的多卤化物离子也已被发现。[27]四氟化钍有着单斜晶系的晶体结构,与四氟化锆及四氟化铪相同,其中Th4+离子与F−离子以扭曲四角反棱柱的方式结合。[27]其它的四卤化物则有着十二面体的几何形状。[28]较低价数的碘化物像是ThI3(黑色)与 ThI2(金色)可以用钍金属去还原四碘化钍来得到,它们只含有Th4+而不含有Th(III)与Th(II),可以电子盐的形式更清楚的写下化学式。[27]许多氟化钍、氯化钍及溴化钍可以和碱金属、钡、铊及铵形成多元卤化物。[27]举例来说,以氟化钾及氢氟酸处理后,Th4+形成错阴离子ThF2−
6,并形成沉淀物K2ThF6。[17]
和对应的铀化合物及钚化合物一样,硼化钍、碳化钍、硅化钍、氮化钍皆是防火材料。这些化合物因可能成为核燃料而引起关注。[20]所有四个更重的氮族化物(磷、砷、锑及铋)皆以二元钍化合物的方式存在。锗化钍也有被发现。[29]钍会与氢反应形成氢化钍像是ThH2及Th4H15,后者在温度低于7.5–8 K形成超导体,常温常压下的导电性质则像是金属。[30]它们在热力学上不稳定,暴露在空气或湿气后会很快的分解。[31]
氮化钍(Th3N4)由炽热的钍与空气中的氮反应而成,有青铜光泽。在空气中它与水汽反应在数小时内分解。[来源请求]钍有三种碳化物,分别是ThC2、Th2C3、ThC,都可由钍或二氧化钍和碳化合制得。ThC与ThC2皆是防火材料,熔点超过2600 °C。[32]

配位化合物
[编辑]在酸性水溶液中,钍以四价水离子[Th(H2O)9]4+的方式存在,形状为三侧锥三角柱,[33][34]在 pH < 3时,钍盐溶液中的阳离子大都是此形式。[33]Th4+离子是最大的四价锕系元素离子,随着配位数的不同,其半径范围为0.95到1.14 Å。[33]因其高电荷它相当酸,比亚硫酸稍强,所以它倾向进行水解及聚合(程度比Fe3+轻),在pH为3或更低的溶液中,主要形成[Th2(OH)2]6+。在碱性较高的溶液中,会继续聚合成凝胶状Th(OH)4沉淀出来(虽然平衡可能需数星期才能达成,因为聚合反应通常在沉淀之前就会慢下来)。[35]身为一个硬路易士酸,Th4+喜好 以氧原子为施体的硬配基,与以硫原子为施体形成的错合物较不稳定,也更容易水解。[10]
因钍的尺寸较大,高配位数为其主要规则。五水硝酸钍是第一个发现的配位数为11的化合物,四水草酸化物配位数为10,硼氢化物(在曼哈顿计划第一次制备)配位数则为14。[35]这些钍盐以在水及极性有机溶剂中的高溶解度而知名。[6]
已发现许多其它的与多原子阴离子形成的无机钍化合物,像是过氯酸盐、硫酸盐、亚硫酸盐、硝酸盐、碳酸盐、磷酸盐、钒酸盐、钼酸盐、铬酸盐及它们的氢化形式。[36]它们在钍的纯化过程及处理核废料中很重要,但它们大多数的性质皆未被全面了解,尤其是它们的结构性质。[36]举例来说,硝酸钍是经由氢氧化钍与硝酸反应而成,溶于水及酒精中,在钍及其化合物的纯化中是重要的中间物。[36]钍与有机配基形成的错合物,像是草酸、柠檬酸与EDTA稳定得多。在自然含钍的水中,有机钍错合物的浓度通常比无机钍错合物大上几个数量级,即使无机配基的浓度比有机配基高得多时也是如此。[33]

有机钍化合物
[编辑]大多有关有机钍化合物专注在环戊二烯基及环辛四烯基上。就像许多前中段的锕系元素(一直到镅,锔也有可能),钍会形成环辛四烯错合物,黄色的双(环辛四烯)合钍 Th(C8H8)2,它的结构与更知名的双(环辛四烯)合铀相同。[37] 它可以用四氯钍与K2C8H8,在THF溶剂里及干冰温度下反应而制得,也可用四氟化钍与MgC8H8反应。[37]它在空气中不稳定,并在水中或190 °C下分解。[37]也有发现半三明治的化合物,像是(η8-C8H8)ThCl2(THF)2,有着钢琴凳结构,可经双(环辛四烯)合钍及四氯化钍在四氢呋喃里反应而得。[10]
最简单的环戊二烯化合物是Th(C5H5)3及Th(C5H5)4,有许多已知的衍生物。前者(有两种形态,紫色和绿色)是一个钍的形式氧化态为+3的稀有例子,[37][38]在某衍生物中也存在+2的形式氧化态。[39]氯衍生物[Th(C5H5)3Cl]可经加热四氯化钍与限量的K(C5H5)(也可使用其它的单价环戊二烯金属化合物)制得。烷基及芳基衍生物可由氯衍生物得到,并曾被用来研究钍碳σ键。[38]
其它的有机钍化合物并未被详细研究。已发现四苄基钍(Th(CH2C6H5))及四丙烯基钍(Th(C3H5)4),但其结构并未确定。它们在室温下缓慢分解。钍会形成侧锥三角柱形的七甲基钍根离子 ([Th(CH3)7]3−),此离子会形成盐类[Li(tmeda)]3[ThMe7](tmeda= Me2NCH2CH2NMe2)。虽然只有一个甲基只接到钍原子上(钍碳距离为257.1 pm),其它六个与钍锂原子相接(钍碳距离为265.5–276.5 pm),它们在溶液中的性质表现是一样的。四甲基钍Th(CH3)4并未被发现,但它的加合物被膦类配体所稳定。[10]
同位素
[编辑]在铋(83号元素)之前的所有元素,几乎都有一种几乎在任何情况下都稳定的同位素(古典稳定),唯锝及钷(43号元素及61号元素)除外。而所有从钋(84号元素)开始的元素的所有同位素,都有可测的放射性。钍-232是在铋-209之后,三种半衰期以亿年计的核种之一(另两个核种是铀-235及铀-238),钍-232的半衰期为140.5亿年,为地球年龄的三倍,与宇宙的年龄相当。地球诞生时产生的钍有五分之四留存至今。[40][41][42]232Th是唯一在自然中大量存在的钍同位素,[40]其稳定性与其闭核壳层中的142颗中子习习相关。[43][44]钍有特定的地球同位素比例,其原子量为232.0377(4)。在地球上有足够存量而得以确定标准原子量的放射性元素有四个,钍为其中之一(另三个为铋、镤及铀)。[1]
钍原子核会因为强核作用力无法克服质子间的电磁排斥力,而发生α衰变。[45]232Th的α衰变是一4n衰变链的开端,此衰变链中核种的核子数皆可被4整除(这也是为什么被取名为4n衰变链,这衰变链也因启始物为钍-232而被称做钍衰变链)。这一系列的α及β衰变以232Th衰变至228Ra为始,止于稳定的208Pb。[40] 任何钍及其化合物的样品,都含有这些后续核种的痕迹,包括了钍、铊、铅、铋、钋、氡、镭及锕的同位素。[40] 自然的钍样品可用化学方式来提纯有用的后续核种,像是可被用做核医学中癌症治疗的212Pb,以及同样可用于α粒子标靶治疗的227Th(会以18.68天的半衰期发射出α粒子)。[46][47][48]在非常偶然地的情况下,232Th会进行自发裂变而非α衰变,在其矿物中留下了此反应的证据(也就是受困其中的反应产物氙气),但其部分半衰期长达1021年,所以α衰变占绝大多数。[49][50]

钍没有稳定同位素,目前已鉴别出32种放射性同位素,核子数从207[51]到238。[49]继最长寿的232Th后,最稳定的同位素分别为230Th(75,380 年)、229Th(7,340 年)、228Th(1.92 年)、234Th (24.10 天)及227Th (18.68 天)。这些同位素都是钍衰变链、锕衰变链、铀衰变链或镎衰变链的一部分,因此得以痕量存于自然界之中。其中镎衰变链的初始同位素237Np因其半衰期为214万年,远少于地球的年龄,因此该条链在自然界中早已衰变殆尽,但如今237Np仍持续因铀矿补捉中子而痕量产生。所有剩余的钍同位素皆为人工合成,半衰期都短于30天,其中大部分的半衰期少于十分钟。[40]
在深海中,同位素230Th占了自然钍的0.02%。[52]这是因为其母核种238U可溶于水,但230Th不溶且会沉淀。含有低浓度钍的铀矿,可以纯化出数克的钍样品,其中230Th占了四分之一,因为230Th是238U的后续核种。[49]国际纯化学和应用化学联合会(IUPAC)在2013年重新在钍分类成双同位素元素,钍在过去曾被认为是单一同位素元素。[53]
钍有三个同核异构体(或称为亚稳态),分别是216m1Th、216m2Th及229mTh。229mTh的激发能在同核异构体中是最低的,[54]约为7.6±0.5 eV。这激发能是如此之低,以致于它进行异构体跃迁时放出的γ射线落在紫外线范围。[55][56][d]
钍的不同同位素化学性质相同,但物理性质有着微小的差异。举例来说,228
Th
、229
Th
、230
Th
及232
Th
的密度分别为11.5、11.6、11.6及11.7 g/cm3。[58]同位素229
Th
被预测可进行核裂变,其裸临界质量为2839公斤,在运用钢反射板可降至994公斤。[58][e]232
Th
不能核分裂,但它是增殖性材料,
在补获中子后可经由β衰变转换成易分裂的233U。[58][59]
放射性定年法
[编辑]有两种放射性定年法牵涉到钍的同位素,分别是建基在234U衰变至230Th的铀钍定年法,及测量232Th及230Th比例的ionium-钍定年法,[f]这两个方法成立是因为232Th是原初放射性元素,230Th只是238U的衰变链的中间产物。[60] 铀钍定年法是相对短期的方法,因为234U及230Th的半衰期比地球年龄来得短。它伴随着一个姊妹过程,牵涉到235U到231Th的α衰变,然后很快的变成长寿的231Pa,这过程常用来验证铀钍定年法的结果。铀钍定年法常被用来判定含碳酸钙物质的年代,像是钟乳石及珊瑚。因为铀比钍及镤更溶于水,所以钍及镤较会沉淀到海床上,其比例就可被测定。这方法的适用范围有数十万年。[60][61]Ionium-钍定年法是相关的过程,利用了钍不溶于水(232Th及230Th都不溶于水)的特性,所以可测量海里沉积物中的232Th及230Th比例,来判定沉积物的年代。[62][63]这两种方法都假设,232Th及230Th比例在沉积物层形成时是固定的,沉积物中不含由铀衰变出的钍,钍也不会在沉积物层间移动。[62][63]
存量
[编辑]生成方式
[编辑]232Th是原初核种,已以现有形式存在数百亿年。它在逝去中的恒星核里,经由R-过程而形成,并由超新星及中子星碰撞散布到银河系中。[64][65]字母R代表快速(rapid)中子补获,发生于核心坍缩的超新星中,重启始核种像是56Fe快速补获中子,沿着中子滴线上升,因中子补获过程比β衰变回到更稳定的核种快得多。中子补获是恒星唯一合成超铁元素的方法,因为在高原子序数下,库仑障壁的上升使得带电粒子间的交互交用更加困难,事实上在56Fe后的核聚变为吸热反应。[66]因为在209Bi后稳定性急促的下降,R-过程是唯一能在星系核种合成中可以产出钍及铀的过程,所有其它的过程都太慢,中间产物在补获到足够的中子前就发生α衰变,无法继续反应产生这些元素。[64][67][68]

在宇宙中,钍是最稀有的原初元素之一,因为它是两个只能经由R-过程产生的元素之一(另一个为铀),也因为它自生成的那刻起就不断的缓慢衰变。比钍稀有的原初元素有铥、镏、钽、铼、在r过程丰度图的第三根峰也就是重铂系金属元素前,带奇原子数的核种、最后还有铀。[64][66][g]在遥远的过去,钚及锔的同位素的衰变会增加钍及铀的丰度;而钍相对于铀的丰度,会因236U衰变至232Th以及235U的自然枯竭而增加,但这些来源早已衰变殆尽且不再造成影响。[69]
在地壳中,钍的存量则高得多,大约占了8.1 ppm,它是存量最多的重元素之一,几乎和铅一样多(13 ppm)且比锡(2.1 ppm)多。[70]这是因为钍喜欢形成不会沈入地心的氧化矿物,它被归类成亲岩元素。常见的钍化合物也难溶于水,所以即使难熔金属在地球上与整个太阳系的存量差不多,地壳中可采集的钍也比其它重铂系金属多。[71]

地球存量
[编辑]自然的钍几乎都是纯232Th,它有着最长的生命且是钍最稳定的同位素,其半衰期与宇宙年龄相当。[49]它的放射衰变热是地热的主要来源,地热其它主要的贡献来自于短命的原初放射核种,依贡献从多到少排列有238U、40K、以及235U。(在地球形成之初,40K及235U贡献更多因为它们的衰变得更快放出更多热,也因衰变得快所以存量减少,现今主要贡献者为232Th及238U。)[76]它的衰变使得地球上钍存量缓慢减少,地球现有钍存量是形成之初的85%。[22]其它自然的钍同位素寿命短得多,其中通常只有230Th可被检测得到,它与其母核种238U达成长期平衡,最多可占自然钍存量的0.04%。[49][h]
只能在大多数矿物的少量成分中发现钍,所以钍在早先被视为稀有。[78]土壤正常含有6 ppm的钍。[79]
自然界中,钍以+4氧化态存在,与铀(IV)、锆(IV)、铪(IV)、铈(IV)、钪、钇以及其它三价镧系元素有着差不多的离子半径。[78]因为钍有放射性,含钍的矿物通常是辐射变晶(非晶形固体),它们的晶体结构被钍的α射线所破坏。[80]硅钙铀钍矿((Ca,Fe,Pb)2(Th,U)Si8O20)是一个极端例子,因其含有的钍而从未被发现不是辐射变晶的情形。[81]
因为在世界各地有大型矿床,独居石(主要是不同稀土元素的磷酸盐)是钍最重要的商业来源,主要产区有印度、南非、巴西、澳洲及马来西亚。它的钍含量平均有2.5%,在某些矿床则可高达20%。[78][82]独居石为黄或棕色,成砂状;化学稳定性高,所以难以从中萃取出钍。[78]褐廉石(主要是不同金属的氢氧硅酸盐)可含有0.1–2%的钍,锆石(主要是硅酸锆)可含有0.4%的钍。[78]
氧化钍存在于稀有矿物方钍石矿中,因为其与二氧化铀为同型矿物,这两种常见的锕系元素氧化物可以形成固态溶液,其名称则因ThO2的含量而有所不同。[78][i] 钍石(主要是硅酸钍,ThSiO4)的钍含量也很高,也是首次发现钍的矿物。[78]在硅酸钍矿里,Th4+及SiO4−
4 离子常被M3+(M= Sc, Y, or Ln)及磷酸根(PO3−
4)所取代。[78]因二氧化钍极其难溶,在释放时,钍通常无法很快地散布于环境之中。Th4+离子可溶,尤其在酸性土壤之中,在酸性条件下钍离子浓度可高达40 ppm。[22]
历史
[编辑]
错误的报告
[编辑]在1815年,瑞典化学家永斯·贝吉里斯分析了从瑞典中部城市法伦的铜矿中得来的不寻常硅铍钇矿样本,他注意到一个白色矿物的浸渍痕迹,并谨慎地假设其为某种未知元素的氧化物。贝吉里斯已经发现了两种元素,铈及硒。但他也曾错误地公开发表了一个新元素gahnium,后来发现其实是氧化锌。[84]在1817年,贝吉里斯私下里以北欧神话的雷神Thor,分别将这假定的元素及其推定的氧化物为命名为thorium及thorina。[85][86]在1824年,在揶威的西阿格德尔郡发现了更多相同矿物的矿床后,他撤回了他的发现,因为这个矿物(后被命为磷钇矿)被证明大多是正磷酸钇。[59][84][87][88]
发现
[编辑]在1828年,Morten Thrane Esmark在挪威泰勒马克郡的Løvøya岛上发现了一种黑色矿物。他是挪威的神父,也是一个业余的矿物学家,在泰勒马克郡研究矿物,并在当地担任神职人员。他常将最有意思的标本,像是这个,寄给他父亲Jens Esmark。他父亲是知名的矿物学家,也是克里斯蒂安尼亚(今奥斯陆)皇家腓特烈大学的矿物学及地质学教授。[89]老Esmark判定这不是已知的矿物,并寄了份样本给贝吉里斯寻求鉴定。贝吉里斯判定这含有一种新元素。[59]在1829年,在利用钾金属还原 KThF5,分离出不纯的样品后,他发表了他的发现。[90][91][92]贝吉里斯重用了之前误判新元素的名称[90][93],将这个矿物命名为thorite。[59]

贝吉里斯对这新金属元素及其化学化合物做了初步的鉴定,他正确地得到了氧化钍中的钍氧质量比7.5(真确值约为7.3),但他假设这新元素是二价而非四价,所以算出的原子量为氧原子量的7.5倍(120 amu),实际上的量应为氧的15倍。[j]他判定钍是一种电正度很高的金属,其电正度比铈高但比锆低。[94]金属形态的钍在1917年第一次被荷兰企业家Dirk Lely Jr.及Lodewijk Hamburger分离出来。[k]
初期化学分类
[编辑]在1869年由门得列夫发表的周期表中,钍及稀土元素被放置在周期表主体之外,也就是在每个垂直周期的底部,碱土金属的后面。这反映出了当时认为钍及稀土元素是二价的。之后得知钍及大部分稀土元素是四价,门得列夫在1871年将铈及钍移到第四族,该族也包含了现代的碳族(第十四族)及钛族(第四族),因为它们最大的氧化态是+4。[97][98]铈很快地从周期表主体中移除,改放到分开的镧系元素中;钍则是因为与其它较轻的第四族元素,像是钛及锆,有着类似的性质,而留在第四族里。[99][l]
初期应用
[编辑]钍在1828年被发现,当到了1885年才开始被应用 奥地利化学家Carl Auer von Welsbach发明了煤气网罩,一种可携带的光源,在燃烧可燃气体加热时会因氧化钍的白炽现象而放光。[59]之后发现了许多钍及其化合物的应用,包括了陶瓷、碳弧光灯、抗热坩埚及工业化学反应的催化剂,像是把氨氧化成硝酸。

放射性
[编辑]在1898年,钍第一次被德国化学家Gerhard Carl Schmidt观测到具有放射性,之后波裔法国物理学家玛丽·居礼也独立发现此事。在1896年法国物理学家亨利·贝克勒发现铀有放射性后,钍是第二个被发现具有放射性的元素。[100][101][102]从1899年开始,新西兰物理学家欧尼斯特·拉塞福及美国电子工程师Robert Bowie Owens研究钍的放射线,早期观察显示它变化幅度巨大。后来他们确定了这些变化来自于一个钍的短命气态子核种,而且发现这是一个新元素。这元素现被命名为氡,除了铀以外,是唯一一个在自然中以钍的子核种被发现的放射性元素。[103]
在计入氡的贡献后,拉塞福,现与英国物理学家弗雷德里克·索迪合作,在1900年到1903年的工作中,证明了钍是如何随着时间以稳定速率,衰变成一系列的其它元素。这观察引起半衰期的鉴定,也就是α粒子实验成果之一,而这又导致了放射性的蜕变理论。[104]放射性的生物效应发现于1903年。[105]这新发现的放射性现象激励了科学家及一般大众。在1920年代,钍的放射性被宣传为风湿、糖尿病及性无能的解药。1932年,在联邦调查放射性的健康影响后,这类使用大多在美国被禁止。[106]在美国,约一万人在X光诊断时被注射钍,他们之后被发现健康出了问题,像是白血病及异常染色体。[22]大众对于放射性的兴趣在1930年末已消退。[106]

进一步分类
[编辑]直到十九世纪末,化学家一致认为钍及铀就像铪及钨的类比,第六排的镧系元素被认为是仅有一次的意外。在1892年,英国化学家Henry Bassett假设了第二个额外的周期表长排,以容纳已知及未发现的元素,并将钍及铀类比成镧系元系。1913年,丹麦物理学家尼尔斯·波耳发现了原子及电子轨域的理论模型,后快的得到了广泛认同。此模型指出了周期表的第七排过渡金属,在填d壳层之前应先填进f壳层,就像第六排中镧系元素位于5d过渡金属之前。[97]第二个内过渡系列以锕系元素的型式存在,并未被接受,直到镧系元系的电子结构相似性被建立之后,才有所改变。[107]波耳建议5f轨域有可能延至铀之后才被填入。[97]
直到发现第一批超铀元素中从钚之后的氧化态像是镧系元素一样主要为+3及+4后,才理解到锕系元系的确是先填入f轨域而非是d轨域,而前段锕系元素的有着类似于过渡金属的化学性质只是例外而非规则。[108]在1975年,在美国物理学家格伦·西奥多·西博格与他的团队发现超铀元素镅及锔后,他理解到钍是锕系元素的第二个成员,并位于f区块中,而非是位于第四d区块,铪的较重同族元素。[99][m]
逐步淘汰
[编辑]在1990年代,因为安全性及环保考量,随着发现更安全的适当替代物后,大多与钍的放射性无关的应用也快速减少。[59][111]尽管钍有放射性,在无法找到适当替代物时,钍依然被使用。1981年,一份由美国橡树岭国家实验室的研究估计,在每周末使用钍煤气网罩,对一个人来说是安全的,[111]但这不适用于制造网罩的工人及一些工厂附近的土壤。[112]有些制造商已改用其它材料,像是钇。[113]直到2007年,一些公司仍持续制造贩卖钍网罩,且未提供与其放射性相关的适当讯息,有些公司更伪称它们不具有放射性。[111][114]
核能发电
[编辑]
钍在原型层级上已被用做电力来源。最早的钍反应爈建于1962年,位于美国纽约洲的Indian Point能源中心。[115]印度有世界上最大钍供应地之一,但印度的铀存量并不多。在1950年代,印度寻求能源独立,推立了三阶段核能计划。[116][117]在大多数国家,铀存量相对得多,而钍反应堆的进度缓慢;在二十世纪,有三个反应堆建于印度,十二个建于他处。[118] 1996年,国际原子能总署开始了钍反应堆的大规模研究;一年后,美国能源部也开始研究。以色列台拉维夫大学的Alvin Radkowsky是宾夕法尼亚州码头市核电站的首席设计师,第一个美国民用钍滋生反应堆。他建立了一个集团来研发钍反应堆,包括了其它实验室: Raytheon Nuclear Inc.、美国的布鲁克黑文国家实验室及俄罗斯的库尔恰托夫研究所。[119]在二十一世纪,钍潜在的减低核扩散能力及它的废料特性重新引起了钍燃料循环的兴趣。[120][121][122]
核武器
[编辑]在冷战时期,美国研究了利用232Th来做为233U来源以制造核弹的可能性,他们在1955年发射了一个测试弹。[123]他们总结233U核弹是非常强力的武器,但是与同时的铀钚核弹相比,它只有少量的可持续技术优势,[124]特别是纯同位素233U难以取得。[123]
生产
[编辑]| 国家 | 储量 |
|---|---|
| 846 | |
| 632 | |
| 595 | |
| 595 | |
| 380 | |
| 374 | |
| 300 | |
| 172 | |
| 155 | |
| 148 | |
| 100 | |
| 87 | |
| 86 | |
| 60 | |
| 50 | |
| 50 | |
| 其它国家 | 1,725 |
| 世界总储量 | 6,355 |
钍的需求量不高,只从矿石提炼钍并不划算,所以钍几乎都是随着稀土元素一起被提炼,稀土元素则有可能是其它矿物生产时的副产物。[125]现在依靠独居石来做生产来源,是因为钍主要是以副产品来生产;若是钍的需求量上升,可以轻易地采用其它含钍量更多的来源,像是钍石。[126]由于目前对于钍的需求不大,对于矿藏分布地区的勘探很少,因此钍资源的分布不是很清楚。[127]在2014年,可用来萃取钍的浓缩独居石的世界产量大约有2700吨。[128]
常见钍的生产过程包括了从浓缩物中的萃取以及纯化,接下来可以选择转成化合物,像是氧化钍。[129]
浓缩
[编辑]可用来萃取钍的钍矿物可分两大类:原生矿床及次生矿床。原生矿床发于酸性花岗岩岩浆及伟晶岩中,浓度高但尺寸小;次生矿床则发于花岗岩山区河口处。在这些矿床中,钍与其它重矿物一起被浓缩。[15]初始浓度随着矿床种类而有所不同。[129]
在原生矿床里,通常由采矿得到伟晶岩后,分成小块再进行浮选。碳酸碱土金属盐可用氢氯酸反应而移除,接下来进行稠化、过滤及锻烧,可得稀土元素含量上达90%的浓缩物。[129]次生矿物(像是海砂)则先进行重力分离,再以一系列渐强的磁铁进行磁力分离。以此法得到的独居石纯度可达98%。[129]
廿世纪的工业生产法,是先在铸铁容器以热浓硫酸处理,再以水稀释并进行选择沉淀。此法依赖于技术上的细节及浓缩物颗粒的大小。曾有许多替代方法被提出,但只有一种被证明经济实惠:以热氢氧化钠进行碱消化。这比原法更贵,但产出更纯的钍,特别的是此法可从浓缩物中移除磷酸盐。[129]
酸消化处理
[编辑]酸消化处理包括两过程,并用到了温度210–230°C,浓度高度93%的硫酸。首先加入60%的硫酸,稠化反应物。再来加入发烟硫酸,并保持定温五小时以降低稀释后的体积。硫酸浓度依反应速度及黏度而定,两者皆随着浓度上升而增加,但黏度增加会使反应变慢。升温也会加速反应,但需避免超过300°C,因为这会产生不可溶的焦磷酸钍。因为溶解会放出很多热,独居石砂不可太快的加入酸里。相反的在温度低于200°C时,反应会太慢以致于不实际。为了保证没有沉淀物会析出于独居石表面而阻碍反应,酸的量必须是石砂的两倍,而不是化学计量得出的60%。之后将混合物却至70°C ,并以十倍体积的冷水稀释,如此一来所有剩余的独居石会沈于底部,而稀土元素及钍会留在溶液中。之后钍可以在pH 1.3下以磷酸盐沉淀而分离, 因为稀土元素直到pH 2才会沉淀。[129]
碱消化处理
[编辑]碱消化是以30–45%的氢氧化钠溶液在140°C处理约三小时。太高温会产出难溶的氧化钍,留下过量的铀在滤液里;碱液浓度太低则会使反应非常缓慢。这些反应条件相当温和,需要独居石砂的大小在45 μm以下。在过滤之后,滤饼会含有以氢氧化物形式存在的钍及稀土元素、以重铀酸钠形式存在的铀与以磷酸钠形式存在的磷酸。降温至60 °C以下时,此滤饼会析出十水磷酸钠的晶体;反应物中有二氧化硅时,铀不纯物的量会上升,在商业使用前需重新结晶。氢氧化物会在80°C溶解于37%的氢氯酸。过滤剩余的沉淀物后,再加入47%的氢氧化钠,会在约pH 5.8左右沉淀出钍及铀。需避免干燥沉淀物,因为空气会氧化铈到+3或+4的氧化态,而铈(IV)可以从氢氯酸中释放出氯。稀土元素会在高pH值时再次沉淀,沉淀物会被原有的氢氧化钠溶液中和,虽然大部分的磷酸必须先移除以避免稀土元素磷酸盐的沉淀。也可先将滤饼溶于硝酸后,再用溶剂萃取出钍及铀。氢氧化钍会绑住钍而妨碍其完全溶解。[129]
纯化
[编辑]核相关应用需要高浓度的钍,特别的是,中子补获截面积很高的原子,浓度必须很低(例如钆的重量浓度须低于百万分之一)。之前,高纯度是用反复溶解及再结晶来达成。现今是使用液态溶剂萃取,这牵涉到选择性的Th4+错合反应,例如在碱消化处理移除磷酸后,剩下的钍、铀及稀土元素等的硝酸错合物可在煤油中以磷酸三正丁酯萃取来分离。[129]
金属钍的提取
[编辑]金属钍是在氩气中或者在真空中氧化钍被钙在高温下还原提取出来的。由于钍会与氢组成化合物因此无法使用氢来还原。还原后使用氟化氢冲洗,然后钍被过滤出来。
应用
[编辑]自1950年代起,[130]因钍及其衰变产物的放射性导致环境上的考量,与放射性无关的应用已逐渐下滑。[59][111]
大多数钍的应用,使用了它的氧化物(在工业界有时称之为thoria)而非钍金属。这化合物熔点高达3300°C(6000°F),是所有已知氧化物中最高的,只有少数物质的熔点比它高。[22]这有助于化合物在火焰中保持固态,而且它明显增加了火焰亮度,这是钍被用在煤气网罩的主要原因。[131]所有物质在高温时都会放出能量(发光),但钍放出的光几乎全是可见光,所以钍制网罩才会这么亮。[25]当钍暴露在能量来源中时,钍会散发出能量,其中有些能量是以可见光的形式释放,能量来源则有可能是阴极射线、热源或是紫外线。氧化铈也有这效应,并在将紫外线转成可见光时有着更高的效率,但是氧化钍有着更高的火焰温度,并放出较少的红外线。[131]钍仍常被用在网罩中,但自1990年代后期已逐渐被钇取代。[132]一份由英国国家辐射防护局在2005年发布的评论指出,“虽然(钍制煤气网罩)在数年前还非常容易取得,但现今已不再是如此。”[133]
从1931年至1940年代末一种稳定的、胶质的二氧化钍混悬剂在血管摄影被作为造影剂使用。但是这个用剂会聚集在微血管中,导致局部放射性过高和癌症。胆癌明显与钍造影剂有关,钍造影剂还能引发一般非常少见的恶性肝脏癌症肝血管肉瘤。此外还有钍造影剂导致鼻腔癌的纪录。一般病发发生在使用30至35年后。今天人们使用硫酸钡和碘化合物取代钍造影剂。[来源请求]
在制造白炽灯丝时,在抽出灯丝前,在钨的烧结粉末加入少量的二氧化钍,可有效降低钨的再结晶。[130]在钨制热阴极中加入少量的钍,可有效降低电子的功函数,所以电子可在低得多的温度被射出。[59]钍会在钨表面形成一原子厚的钍层。钍表面的功函数之所以会降低,有可能是因钍较大的电正性而在钍与钨之间形成的电场所导致。[134]自1920年代起,含钍钨线被用在真空管、 X射线管的阴极和对阴极、以及整流器里。因为钍与大气中氧及氮的反应性,钍也用作真空管中的吸气剂。1950年代引进晶体管后,此类需求大幅减少,但并未完全消失。[130]在钨极气体保护电弧焊中,二氧化钍被用来增加钨电极的高温强度以及电弧的稳定性。[59]在这项应用中,氧化钍正被其它氧化物,像是锆、铈及镧的氧化物所取代。[135][136]
二氧化钍被用在耐高温的陶瓷中,像是实验室的高温坩埚,[59],或者是主要成分,或者作为二氧化锆的添加物。由90%铂及10%钍的合金,是把氨氧化成氮氧化物的催化剂,但这已被95%铂及5%铑的合金所取代,因其有着更好的机械性质及更高的耐用度。[130]

作为玻璃的添加物,二氧化钍可增加折射率及降低色散。这种玻璃可用于摄影机及科学器材里的高品质透镜。[16]这些透镜的放射线会让透镜变暗,也会在几年间让透镜慢慢变黄,并损害底片,但健康风险不大。[137]发黄的透镜在长期暴露在强紫外线下后,即可回复透明无色。在此应用中,二氧化钍已被稀土氧化物取代,因为它们提供类似效果但无放射性。[130]
四氟化钍在多层光学涂膜中可用作抗反射材料,它在电磁波段0.35–12 µm的范围是透明的,大约对应到近紫外线、可见光及中红外线。它的放射线主要是α粒子,可被另一层薄膜轻易挡下。[138]自2010年代后,四氟化钍的取代物正在研发中。[139]
Mag-Thor合金(也被称为含钍镁)被用于航太应用中,但这些应用因其放射性而逐渐淡出。
核能之潜在应用
[编辑]| 237Np | ||||||||||||||
| ↑ | ||||||||||||||
| 231U | ← | 232U | ↔ | 233U | ↔ | 234U | ↔ | 235U | ↔ | 236U | → | 237U | ||
| ↓ | ↑ | ↑ | ↑ | |||||||||||
| 231Pa | → | 232Pa | ← | 233Pa | → | 234Pa | ||||||||
| ↑ | ↑ | |||||||||||||
| 230Th | → | 231Th | ← | 232Th | → | 233Th | ||||||||
| ||||||||||||||
核反应堆的主要能量来源是中子引发的核分裂。自然存在的232Th及238U补获中子后,可分别增殖人造易分裂[e]核种233U及239Pu。存在于自然界的235U也是易分裂核种。[140][141][n]在钍燃料循环中,增殖性材料232Th被慢中子所轰炸,补获中子后变成233Th,然后连续β衰变两次,先变成233Pa再变成易分裂的233U:[59]
- 232
90Th
+ n → 233
90Th
+ γ 233
91Pa
233
92U
233U是易分裂核种,可以用与235U及239Pu一样的方式当做核燃料。233U核分裂时发射出的中子可以进一步的撞击232Th核种延续循环。[59]这与快中子增殖反应堆中的铀燃料循环同时进行,其中238U补获中子变成239U,β衰变成239Np后,再β衰变成易分裂核种239Pu。[142]
优点
[编辑]由于钍比铀常见得多,因此可为世界供能更久。[143]
232Th比238U更易捕获中子,且比起235U和239Pu,钍产生的233U吸收中子后更易裂变[144]、释放中子更多。[143]238U仅需捕获一个中子就会产生239Pu及各种超铀元素废料,但232Th需要捕获五个中子才会产生超铀元素废料237Np。232Th捕获中子的过程中产生的233U及235U在捕获中子后都容易裂变,因此只有少数232Th能捕获中子至产生超铀元素。这也使得钍有潜力替代混合氧化物核燃料中的铀,减少超铀元素的产生,还能消耗掉燃料中的钚。[145]
二氧化钍熔点高、热导率高、热膨胀系数低,因此钍燃料能使反应堆堆芯更安全、更有效。[59]二氧化钍的化学性质比二氧化铀稳定,后者会因为被氧化成八氧化三铀(U
3O
8)而降低密度。[146]
缺点
[编辑]钍产生的乏核燃料危险、难以处理,因为其中含有232Th及233U的各种衰变产物,其中不乏有会放出强γ射线的核素。[143]233U的生产都会因为232Th中的230Th杂质,抑或是使核素失去一个中子的副反应,产生232U杂质。[147]
- 230
90Th
+ n → 231
90Th
+ γ 231
91Pa
( 227
89Ac
) - 231
91Pa
+ n → 232
91Pa
+ γ 232
92U
232U本身不是很危险,但它会快速衰变成强γ射线源208Tl。[148][o]233U中含有的232U杂质使它危险,且因为分离并不实际,难以将233U用于核武器扩散。[147]233Pa有较长的半衰期,达27天,且中子捕获截面高,因此是中子毒物。大量的233Pa不会快速衰变为有用的233U,而是消耗中子并转化为234U,降低中子经济。为了避免此事发生,需要将233Pa从熔盐堆中分离,使它无法捕获中子,只能衰变成233U。[149]
要想实现232Th的优点,就需要成熟的技术,而这种技术要比铀、钚燃料所需的技术更先进。[59]钍燃料循环的商业可行性低,[150][151][152]经合组织核能署就预测在铀尚能大量获得的几十年内,钍燃料循环在商业上不可行。[153]虽然钍燃料循环产生的超铀元素较少,但不是超铀元素的231Pa也相当危险。它的半衰期是32760年,是乏核燃料长期危害的主要成因。[149]
安全
[编辑]放射性
[编辑]钍的半衰期长,衰变放出的α粒子无法穿透皮肤,因此煤气网罩中少量的钍仍是安全的。[154]由于α粒子可穿透体内的器官,因此暴露于含钍的气溶胶下会提高肺癌、胰脏癌、血癌的风险。[154]钍的内照射会提高患肝病的风险。 [155]
232Th的衰变产物包括比它本身更危险的镭与氡。虽然因为钍衰变缓慢,衰变产物的含量较少;但是真正评估232Th的放射性危害需要考量这些衰变产物。232Th的衰变链中没有长寿命同位素,因此在232Th衰变后,产生的衰变产物会快速完成衰变链剩余的部分,[156]其中不乏有会放出γ射线的危险同位素。[157]由于衰变产物的熔点都远低于二氧化钍,它们在煤气网罩使用时都会挥发出来。在使用煤气网罩一小时后,钍的衰变产物224Ra、228Ra、212Pb、212Bi大多都会挥发。[158]使用者每次使用煤气网罩时都会因吸入衰变产物,接受到0.2毫西弗的辐射,约为乳房摄影术辐射的三分之一。[159]
一些核安全机构就煤气网罩的使用提出了建议,并提出了其制造和处置的安全问题。一个煤气网罩产生的辐射不是大问题,但工厂或垃圾填埋场集中的大量煤气网罩产生的辐射就是大问题了。[155]
化学毒性
[编辑]钍无臭无味。[160]钍及其最常见的化合物二氧化钍都难溶于水,[161]可溶的钍化合物也都会被转化成氢氧化钍沉淀,[162]因此化学毒性较低。在柠檬酸根等可与钍离子形成可溶配合物的离子存在下,钍化合物会因为被人体吸收,显示毒性。[156]钍难溶于水意味着它通过肾脏与粪便排出体外的速度缓慢。[156]当含钍物体被咀嚼、吞下后,其中含有的钍只有0.4%进入人体,但钍危险的衰变产物会有90%进入人体。[114]进入人体的钍有四分之三会在骨骼累积。虽然钍有可能被皮肤吸收,但这不太可能是主要的暴露方式。[154]
暴露源
[编辑]钍在哪里都有微量存在。人体内约含有40微克的钍,每天都会通过进食摄入3微克的钍。[22]人大多通过吸入粉尘接触钍,而食物中的钍由于溶解度较低,其摄入量可以忽略不计。[156]
居住在钍矿床或放射性废物处理场附近的人,铀、磷酸盐、锡加工厂的工人和附近的居民,以及从事煤气网罩生产的人的钍暴露量都会增加。[163]印度淡米尔纳德邦富含钍,因此当地居民得到的来自钍的辐射会比其它地区高出十倍。[164]巴西北部沿海地区的瓜拉帕里有放射性的独居石沙滩,因此当地的辐射高达全球平均值的50倍。[165]
钍可用于制造某些导弹的制导系统,因此钍的另一暴露源是武器试验场中产生的含钍粉尘。这被认为是意大利撒丁大区萨尔托迪奎拉试验场先天性障碍和癌症发病率高的原因。[166]
注解
[编辑]- ^ 铋-209的放射性极其微弱,且其半衰期(1.9×1019 年)比地球年龄长得多,几乎可以视为稳定同位素。
- ^ 低于锇、钽、钨及铼。[4]第7周期的过渡金属预测具有高沸点,但其制量过少难以验证。[8]
- ^ 和之前锕系元素与过渡元素的相似性不同,与主族元素的相似性大部分止于钍,而未延伸到锕系元素的后半段。因为在共价键中5f轨域的贡献逐渐增加。在常见的锕系元素中,除了钍只剩下铀。铀残存着一些主族元素的特性。除了铀最常见的两个氧化态铀(VI)及铀(IV),铀的化学比钍复杂得多,这两个态与其它更高的形式上失去所有价电子的氧化态不同,这些更高的氧化态行为与p区块的重主族元素类似。[13]
- ^ γ射线并不是通过波长区分的,而是只要是从原子核放出的就叫γ射线,所以放射性元素衰变出的γ射线的波长并无上限。[57]
- ^ 5.0 5.1 可核分裂的核种,是指在补获高能量中子后, 可以进行核分裂的核种(即使几率很低)。有些核种可被低能量的热中子以高几率引发核分裂,它们被称为“易分裂核种”。“增殖性材料”是指可以被中子轰炸后产生易分裂核种的核种。临界质量是指可以持续进行核连锁反应的球形物质的质量。
- ^ ionium 其实就是230Th。在早期不同同位素不被认为是同一种元素,所以有者不同的名字。
- ^ 带偶数质子或偶数中子的同位素一般会比带奇数的同位素更稳定,奇原子序数的元素最多只有两个稳定的同位素,偶原子序数的元素则有多个稳定同位素,像是锡(50号元素)有十个。 [40]
- ^ 其它同位素可能伴随着232Th而出现,但只有痕量大小。如果来源不含铀,其它唯一会出现的钍同位素是228Th,它存在于232Th的衰变链(钍系列)中,228Th与232Th的比例会低于10−10。[49]如果来源含铀,会出现其它痕量大小的钍同位素,包括从235U衰变链(锕系列)中来的231Th和227Th,以及从238U衰变链(铀系列)中来的,存量较多但仍是痕量的234Th和230Th。[49]229Th会从237Np的衰变链(镎系列)中产生,所有原初的237Np皆已绝迹,但它仍会由铀矿的核反应所产生。[77]229Th大多 是人工中子活化的232Th产生的233U的衰变产物,自然产生的229Th极度稀有。[49]
- ^ 75–100 mol% ThO2称之为方钍石,25–75 mol% ThO2称之为铀方钍石,15–25 mol% ThO2称之为钍沥青铀矿,0–15 mol% ThO2称之为沥青铀矿。[78]
- ^ 在当时,包括了钍及自然界中与其紧密伴随元素的稀土元素被认为是二价,稀土元素的原子量变成了真值的三分之二,钍及铀则为真值的一半。
- ^ 分离出钍的主要困难不是在于其电正度,而是难以与自然界中与其紧密伴随的其它稀土元素及铀分离。瑞典化学家拉尔斯·弗雷德里克·尼尔松,也是钪的发现者,在1882年曾试图分离出钍金属,但无法得到高纯度的钍。[95] Lely与Hamburger利用钠金属还原氯化钍,得到了纯度99%的钍金属。[96]在1927年,美国工程师 John Marden与Harvey Rentschler发现了一个更简单的办法可以达到更高纯度,在氯化钙的存在下利用钙还原氧化钍。[96]
- ^ 钍也出现在1864年英国化学家约翰·纽兰兹的周期表中,是其最后且最重的元素,因为早期认为铀是三价且原子量大约是120,由于铀绝大多数是六价,此为真值的一半。钍也在1864年英国化学家威廉·奥德林的周期表中担任最重的元素,并处于钛、锆及钽之下。钍并未出现在1862年法国地质学家Alexandre-Émile Béguyer de Chancourtois,1867年德裔美国音乐家Gustav Hinrichs,以及1870年德国化学家尤利乌斯·洛塔尔·迈耶尔等的周期表中,这些周期表均未纳入稀土元素及钍。[97]
- ^ 确定5f子壳层是从锕系前段开始被填入,是在1964年下一个元素𬬻第一次被合成出来后;当时发现𬬻表现像是铪,就像5f轨域被填满后所预期的一样。 [109]现今钍依然因其与铪的相似性,而有时被称为“准第四族元素”。[110]
- ^ 十三种半生期超过一年的锕系元素易分裂同位素有229Th、233U、235U、236Np、239Pu、241Pu、242mAm、243Cm、245Cm、247Cm、249Cf、251Cf及252Es。这之中只有235U是自然存在,而且只有233U和239Pu可从自然核种补获单中子而得。[141]
- ^ 232Th也会衰变成208Tl,但由于232Th半衰期很长,所以其衰变产生的208Tl量可以忽略。
参考文献
[编辑]- ^ 1.0 1.1 Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- ^ Chaoxian, Chi; Sudip, Pan; Jiaye, Jin; Luyan, Meng; Mingbiao, Luo; Lili, Zhao; Mingfei, Zhou; Gernot, Frenking. Octacarbonyl Ion Complexes of Actinides [An(CO)8]+/− (An=Th, U) and the Role of f Orbitals in Metal–Ligand Bonding. Chemistry (Weinheim an der Bergstrasse, Germany). 25 (50): 11772–11784. 2019, 25 (50): 11772–11784. ISSN 0947-6539. PMC 6772027
 . PMID 31276242. doi:10.1002/chem.201902625.
. PMID 31276242. doi:10.1002/chem.201902625.
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2011-03-03., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ 4.00 4.01 4.02 4.03 4.04 4.05 4.06 4.07 4.08 4.09 4.10 4.11 4.12 4.13 Wickleder, Fourest & Dorhout 2006,第61–63页.
- ^ Gale, W. F.; Totemeier, T. C. Smithells Metals Reference Book. Butterworth-Heinemann. 2003: 15–2–15–3. ISBN 978-0-08-048096-1 (英语).
- ^ 6.0 6.1 6.2 6.3 6.4 Tretyakov, Yu. D. (编). Non-organic chemistry in three volumes. Chemistry of transition elements 3. Academy. 2007. ISBN 978-5-7695-2533-9.
- ^ 7.0 7.1 Johansson, B.; Abuja, R.; Eriksson, O.; et al. Anomalous fcc crystal structure of thorium metal.. Physical Review Letters. 1995, 75 (2): 280–283. Bibcode:1995PhRvL..75..280J. PMID 10059654. doi:10.1103/PhysRevLett.75.280.
- ^ Fricke, Burkhard. Superheavy elements: a prediction of their chemical and physical properties. Structure and Bonding 21. 1975: 89–144 [2013-10-04]. ISBN 978-3-540-07109-9. doi:10.1007/BFb0116498.
|journal=被忽略 (帮助) - ^ Wickleder, Fourest & Dorhout 2006,第59–60页.
- ^ 10.0 10.1 10.2 10.3 Cotton, S. Lanthanide and Actinide Chemistry. John Wiley & Sons. 2006.
- ^ Martin, W. C.; Hagan, L.; Reader, J.; et al. Ground Levels and Ionization Potentials for Lanthanide and Actinide Atoms and Ions (PDF). J. Phys. Chem. Ref. Data. 1974, 3 (3): 771–779 [2013-10-19]. Bibcode:1974JPCRD...3..771M. doi:10.1063/1.3253147. (原始内容 (PDF)存档于2016-03-04).
- ^ Cotton, S. Lanthanide and Actinide Chemistry. John Wiley & Sons. 2006: 150.
- ^ 13.0 13.1 King, R. Bruce. Inorganic Chemistry of Main Group Elements. Wiley-VCH. 1995. ISBN 978-0-471-18602-1.
- ^ Greenwood & Earnshaw 1997,第1262页.
- ^ 15.0 15.1 Stoll 2005,第6页.
- ^ 16.0 16.1 Hammond, C. R. The Elements, in Handbook of Chemistry and Physics 81st. CRC Press. 2004. ISBN 978-0-8493-0485-9.
- ^ 17.0 17.1 Hyde, E. K. The radiochemistry of thorium (PDF). National Academy of Sciences. 1960 [2017-09-29]. (原始内容 (PDF)存档于2021-03-05).
- ^ Greenwood & Earnshaw 1997,第1264页.
- ^ Moore, Robert Lee; Goodall, C. A.; Hepworth, J. L.; Watts, R. A. Nitric Acid Dissolution of Thorium. Kinetics of Fluoride-Catalyzed Reaction. Industrial & Engineering Chemistry. May 1957, 49 (5): 885–887. doi:10.1021/ie50569a035.
- ^ 20.0 20.1 Greenwood & Earnshaw 1997,第1267页.
- ^ Yamashita, Toshiyuki; Nitani, Noriko; Tsuji, Toshihide; Inagaki, Hironitsu. Thermal expansions of NpO2 and some other actinide dioxides. J. Nucl. Mater. 1997, 245 (1): 72–78. Bibcode:1997JNuM..245...72Y. doi:10.1016/S0022-3115(96)00750-7.
- ^ 22.0 22.1 22.2 22.3 22.4 22.5 Emsley, J. emsley blocks: an A–Z guide to the elements. Oxford University Press. 2011: 544–548. ISBN 978-0-19-960563-7.
- ^ 23.0 23.1 Wickleder, Fourest & Dorhout 2006,第70–77页.
- ^ Greenwood & Earnshaw 1997,第1269页.
- ^ 25.0 25.1 25.2 Ivey, H. F. Candoluminescence and radical-excited luminescence. Journal of Luminescence. 1974, 8 (4): 271–307. Bibcode:1974JLum....8..271I. doi:10.1016/0022-2313(74)90001-5.
- ^ Wickleder, Fourest & Dorhout 2006,第95–97页.
- ^ 27.0 27.1 27.2 27.3 27.4 Wickleder, Fourest & Dorhout 2006,第78–94页.
- ^ 28.0 28.1 Greenwood & Earnshaw 1997,第1271页.
- ^ Wickleder, Fourest & Dorhout 2006,第97–101页.
- ^ Wickleder, Fourest & Dorhout 2006,第64–66页.
- ^ Greenwood & Earnshaw 1997,第127页.
- ^ Wickleder, Fourest & Dorhout 2006,第66–70页.
- ^ 33.0 33.1 33.2 33.3 Wickleder, Fourest & Dorhout 2006,第117–134页.
- ^ Persson, I. Hydrated metal ions in aqueous solution: How regular are their structures?. Pure and Applied Chemistry. 2010, 82 (10): 1901–1917. doi:10.1351/PAC-CON-09-10-22.
- ^ 35.0 35.1 Greenwood & Earnshaw 1997,第1275–1277页.
- ^ 36.0 36.1 36.2 Wickleder, Fourest & Dorhout 2006,第101–115页.
- ^ 37.0 37.1 37.2 37.3 Wickleder, Fourest & Dorhout 2006,第116–117页.
- ^ 38.0 38.1 Greenwood & Earnshaw 1997,第1278–1280页.
- ^ Langeslay, Ryan R.; Fieser, Megan E.; Ziller, Joseph W.; Furche, Philip; Evans, William J. Synthesis, structure, and reactivity of crystalline molecular complexes of the {[C5H3(SiMe3)2]3Th}1− anion containing thorium in the formal +2 oxidation state. Chemical Science. 2015, 6 (6): 517–521. PMC 5811171
 . PMID 29560172. doi:10.1039/C4SC03033H.
. PMID 29560172. doi:10.1039/C4SC03033H.
- ^ 40.0 40.1 40.2 40.3 40.4 40.5 Audi, G.; Bersillon, O.; Blachot, J.; et al. The NUBASE evaluation of nuclear and decay properties (PDF). Nuclear Physics A. 2003, 729 (1): 3–128. Bibcode:2003NuPhA.729....3A. CiteSeerX 10.1.1.692.8504
 . doi:10.1016/j.nuclphysa.2003.11.001. (原始内容 (PDF)存档于2013-07-24).
. doi:10.1016/j.nuclphysa.2003.11.001. (原始内容 (PDF)存档于2013-07-24).
- ^ de Laeter, John Robert; Böhlke, John Karl; De Bièvre, Paul; Hidaka, Hiroshi; Peiser, H. Steffen; Rosman, Kevin J. R.; Taylor, Philip D. P. Atomic weights of the elements. Review 2000 (IUPAC Technical Report). Pure and Applied Chemistry. 2003, 75 (6): 683–800. doi:10.1351/pac200375060683.
- ^ International Union of Pure and Applied Chemistry. Atomic weights of the elements 2005 (IUPAC Technical Report) (PDF). Pure and Applied Chemistry. 2006, 78 (11): 2051–2066 [2017-07-27]. doi:10.1351/pac200678112051. (原始内容 (PDF)存档于2018-07-12).
- ^ Nagy, S. Radiochemistry and Nuclear Chemistry 2. EOLSS Publications. 2009: 374. ISBN 978-1-84826-127-3.
- ^ Griffin, H. C. Natural Radioactive Decay Chains. Vértes, A.; Nagy, S.; Klencsár, Z.; et al (编). Handbook of Nuclear Chemistry. Springer Science+Business Media. 2010: 668. ISBN 978-1-4419-0719-6.
- ^ Beiser, A. Nuclear Transformations (PDF). Concepts of Modern Physics 6. McGraw-Hill Education. 2003: 432–434 [2019-07-13]. ISBN 978-0-07-244848-1. (原始内容 (PDF)存档于2016-10-04).
- ^ Ramdahl, Thomas; Bonge-Hansen, Hanne T.; Ryan, Olav B.; Larsen, Åsmund; Herstad, Gunnar; Sandberg, Marcel; Bjerke, Roger M.; Grant, Derek; Brevik, Ellen M. An efficient chelator for complexation of thorium-227. Bioorganic & Medicinal Chemistry Letters. 2016-09-01, 26 (17): 4318–4321. ISSN 0960-894X. PMID 27476138. doi:10.1016/j.bmcl.2016.07.034.
- ^ Deblonde, Gauthier J.-P.; Lohrey, Trevor D.; Booth, Corwin H.; Carter, Korey P.; Parker, Bernard F.; Larsen, Åsmund; Smeets, Roger; Ryan, Olav B.; Cuthbertson, Alan S. Solution Thermodynamics and Kinetics of Metal Complexation with a Hydroxypyridinone Chelator Designed for Thorium-227 Targeted Alpha Therapy. Inorganic Chemistry. 2018-11-19, 57 (22): 14337–14346 [2019-07-13]. ISSN 0020-1669. PMID 30372069. doi:10.1021/acs.inorgchem.8b02430. (原始内容存档于2021-05-11).
- ^ Captain, Ilya; Deblonde, Gauthier J.-P.; Rupert, Peter B.; An, Dahlia D.; Illy, Marie-Claire; Rostan, Emeline; Ralston, Corie Y.; Strong, Roland K.; Abergel, Rebecca J. Engineered Recognition of Tetravalent Zirconium and Thorium by Chelator–Protein Systems: Toward Flexible Radiotherapy and Imaging Platforms. Inorganic Chemistry. 2016-11-21, 55 (22): 11930–11936 [2019-07-13]. ISSN 0020-1669. PMID 27802058. doi:10.1021/acs.inorgchem.6b02041. (原始内容存档于2021-04-29).
- ^ 49.0 49.1 49.2 49.3 49.4 49.5 49.6 49.7 Wickleder, Fourest & Dorhout 2006,第53–55页.
- ^ Bonetti, R.; Chiesa, C.; Guglielmetti, A.; et al. First observation of spontaneous fission and search for cluster decay of 232Th. Physical Review C. 1995, 51 (5): 2530. Bibcode:1995PhRvC..51.2530B. doi:10.1103/PhysRevC.51.2530.
- ^ Yang, H. B.; et al. New isotope 207Th and odd-even staggering in α-decay energies for nuclei with Z > 82 and N < 126. Physical Review C. 2022, 105 (L051302). Bibcode:2022PhRvC.105e1302Y. S2CID 248935764. doi:10.1103/PhysRevC.105.L051302.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. The NUBASE2020 evaluation of nuclear properties (PDF). Chinese Physics C. 2021, 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Standard Atomic Weights: Thorium. CIAAW. 2013 [2024-10-27]. (原始内容存档于2024-12-09).
- ^ Ruchowska, E.; Płóciennik, W. A.; Żylicz, J.; et al. Nuclear structure of 229Th. Physical Review C. 2006, 73 (4): 044326 [2019-07-13]. Bibcode:2006PhRvC..73d4326R. doi:10.1103/PhysRevC.73.044326. hdl:10261/12130. (原始内容存档于2021-04-28).
- ^ Beck, B. R.; Becker, J. A.; Beiersdorfer, P.; et al. Energy splitting in the ground state doublet in the nucleus 229Th. Physical Review Letters. 2007, 98 (14): 142501. Bibcode:2007PhRvL..98n2501B. PMID 17501268. doi:10.1103/PhysRevLett.98.142501.
- ^ von der Wense, L.; Seiferle, B.; Laatiaoui, M.; et al. Direct detection of the 229Th nuclear clock transition. Nature. 2016, 533 (7601): 47–51. Bibcode:2016Natur.533...47V. PMID 27147026. arXiv:1710.11398
 . doi:10.1038/nature17669.
. doi:10.1038/nature17669.
- ^ Feynman, R.; Leighton, R.; Sands, M. The Feynman Lectures on Physics 1. Addison-Wesley. 1963: 2–5 [2018-01-13]. ISBN 978-0-201-02116-5.
- ^ 58.0 58.1 58.2 Evaluation of nuclear criticality safety data and limits for actinides in transport (PDF). Institut de radioprotection et de sûreté nucléaire: 15. [2010-12-20]. (原始内容 (PDF)存档于2007-07-10).
- ^ 59.00 59.01 59.02 59.03 59.04 59.05 59.06 59.07 59.08 59.09 59.10 59.11 59.12 59.13 Wickleder, Fourest & Dorhout 2006,第52–53页.
- ^ 60.0 60.1 3–6: Uranium Thorium Dating (PDF). Institute for Structure and Nuclear Astrophysics, University of Notre Dame. [2017-10-07]. (原始内容 (PDF)存档于2021-04-21).
- ^ Davis, O. Uranium-Thorium Dating. Department of Geosciences, University of Arizona. [2017-10-07]. (原始内容存档于2017-03-28).
- ^ 62.0 62.1 Rafferty, J. P., Geochronology, Dating, and Precambrian Time: The Beginning of the World As We Know It, The Geologic History of Earth, Rosen Publishing: 150, 2010, ISBN 978-1-61530-125-6
- ^ 63.0 63.1 Vértes, A., Nagy, S.; Klencsár, Z.; Lovas, R. G.; et al , 编, Handbook of Nuclear Chemistry 5 2nd, Springer Science+Business Media: 800, 2010, ISBN 978-1-4419-0719-6
- ^ 64.0 64.1 64.2 Cameron, A. G. W. Abundance of the Elements in the Solar System (PDF). Space Science Reviews. 1973, 15 (1): 121–146. Bibcode:1973SSRv...15..121C. doi:10.1007/BF00172440. (原始内容 (PDF)存档于2011-10-21).
- ^ Frebel, Anna; Beers, Timothy C. The formation of the heaviest elements. Physics Today. 2018, 71 (1): 30–37. Bibcode:2018PhT....71a..30F. ISSN 0031-9228. arXiv:1801.01190
 . doi:10.1063/pt.3.3815.
. doi:10.1063/pt.3.3815.
- ^ 66.0 66.1 Roederer, I. U.; Kratz, K.-L.; Frebel, A.; et al. The End of Nucleosynthesis: Production of Lead and Thorium in the Early Galaxy. The Astrophysical Journal. 2009, 698 (2): 1963–1980. Bibcode:2009ApJ...698.1963R. arXiv:0904.3105
 . doi:10.1088/0004-637X/698/2/1963.
. doi:10.1088/0004-637X/698/2/1963.
- ^ Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; et al. Synthesis of the Elements in Stars (PDF). Reviews of Modern Physics. 1957, 29 (4): 547 [2019-07-20]. Bibcode:1957RvMP...29..547B. doi:10.1103/RevModPhys.29.547. (原始内容 (PDF)存档于2016-06-24).
- ^ Clayton, D. D. Principles of Stellar Evolution and Nucleosynthesis. McGraw-Hill Education. 1968: 577–591. ISBN 978-0-226-10953-4.
- ^ Stoll 2005,第2页.
- ^ Greenwood & Earnshaw 1997,第1294页.
- ^ Albarède, F. Geochemistry: an introduction. Cambridge University Press. 2003: 17. ISBN 978-0-521-89148-6.
- ^ Trenn, T. J. Thoruranium (U-236) as the extinct natural parent of thorium: The premature falsification of an essentially correct theory. Annals of Science. 1978, 35 (6): 581–597. doi:10.1080/00033797800200441.
- ^ Diamond, H.; Friedman, A. M.; Gindler, J. E.; et al. Possible Existence of Cm247 or Its Daughters in Nature. Physical Review. 1956, 105 (2): 679–680. Bibcode:1957PhRv..105..679D. doi:10.1103/PhysRev.105.679.
- ^ Rao, M. N.; Gopalan, K. Curium-248 in the Early Solar System. Nature. 1973, 245 (5424): 304–307. Bibcode:1973Natur.245..304R. doi:10.1038/245304a0.
- ^ Rosenblatt, D. B. Effects of a Primeval Endowment of U236. Physical Review. 1953, 91 (6): 1474–1475. Bibcode:1953PhRv...91.1474R. doi:10.1103/PhysRev.91.1474.
- ^ Gando, A.; Gando, Y.; Ichimura, K.; et al. Partial radiogenic heat model for Earth revealed by geoneutrino measurements (PDF). Nature Geoscience. 2011, 4 (9): 647–651 [2019-07-28]. Bibcode:2011NatGe...4..647K. doi:10.1038/ngeo1205. (原始内容 (PDF)存档于2021-03-07).
- ^ Peppard, D. F.; Mason, G. W.; Gray, P. R.; et al. Occurrence of the (4n + 1) Series in Nature. Journal of the American Chemical Society. 1952, 74 (23): 6081–6084. doi:10.1021/ja01143a074.
- ^ 78.0 78.1 78.2 78.3 78.4 78.5 78.6 78.7 78.8 Wickleder, Fourest & Dorhout 2006,第55–56页.
- ^ Agency for Toxic Substances and Disease Registry. Thorium (PDF) (报告). 2016 [2017-09-30]. (原始内容 (PDF)存档于2021-04-12).
- ^ Woodhead, J. A. The metamictization of zircon: Radiation dose-dependent structural characteristics (PDF). American Mineralogist. 1991, 76: 74–82 [2019-07-28]. (原始内容 (PDF)存档于2021-05-05).
- ^ Szymański, J. T. A mineralogical study and crystal-structure determination of nonmetamict ekanite, ThCa2Si8O20 (PDF). Canadian Mineralogist. 1982, 20: 65–75 [2019-07-28]. (原始内容 (PDF)存档于2021-02-25).
- ^ Greenwood & Earnshaw 1997,第1255页.
- ^ Tor's Fight with the Giants. Google Arts & Culture. [2016-06-26]. (原始内容存档于2016-10-09) (英语).
- ^ 84.0 84.1 Fontani, M.; Costa, M.; Orna, V. The Lost Elements: The Periodic Table's Shadow Side. Oxford University Press. 2014: 73. ISBN 978-0-19-938334-4.
- ^ Ryabchikov, D. I.; Gol'braikh, E. K. The Analytical Chemistry of Thorium: International Series of Monographs on Analytical Chemistry. Elsevier. 2013: 1. ISBN 978-1-4831-5659-0.
- ^ Thomson, T. A System of Chemistry of Inorganic Bodies 1. Baldwin & Cradock and William Blackwood. 1831: 475.
- ^ Berzelius, J. J. Undersökning af några Mineralier. 1. Phosphorsyrad Ytterjord. [Examining some minerals. 1st phosphoric yttria.]. Kungliga Svenska Vetenskapsakademiens Handlingar. 1824, 2: 334–338 (瑞典语).
- ^ Xenotime-(Y). Mindat database. [2017-10-07]. (原始内容存档于2017-03-16).
- ^ Selbekk, R. S. Morten Thrane Esmark. Store norske leksikon. Kunnskapsforlaget. 2007 [2009-05-16]. (原始内容存档于2021-04-28) (挪威语).
- ^ 90.0 90.1 Weeks, M. E. The discovery of the elements. XI. Some elements isolated with the aid of potassium and sodium: Zirconium, titanium, cerium, and thorium. Journal of Chemical Education. 1932, 9 (7): 1231. Bibcode:1932JChEd...9.1231W. doi:10.1021/ed009p1231.
- ^ Berzelius, J. J. Untersuchung eines neues Minerals und einer darin erhalten zuvor unbekannten Erde [Investigation of a new mineral and of a previously unknown earth contained therein]. Annalen der Physik und Chemie. 1829, 16 (7): 385–415 [2019-07-28]. Bibcode:1829AnP....92..385B. doi:10.1002/andp.18290920702. (原始内容存档于2021-04-27) (德语). (modern citation: Annalen der Physik, vol. 92, no. 7, pp. 385–415).
- ^ Berzelius, J. J. Undersökning af ett nytt mineral (Thorit), som innehåller en förut obekant jord [Investigation of a new mineral (thorite), as contained in a previously unknown earth]. Kungliga Svenska Vetenskaps Akademiens Handlingar. 1829: 1–30 (瑞典语).
- ^ Schilling, J. Die eigentlichen Thorit-Mineralien (Thorit und Orangit) [The actual thoritic minerals (thorite and orangite)]. Zeitschrift für Angewandte Chemie. 1902, 15 (37): 921–929. doi:10.1002/ange.19020153703 (德语).
- ^ Leach, M. R. The Internet Database of Periodic Tables: Berzelius' Electronegativity Table. [2016-07-16]. (原始内容存档于2021-04-28).
- ^ Nilson, L. F. Über metallisches Thorium [About metallic thorium]. Berichte der Deutschen Chemischen Gesellschaft. 1882, 15 (2): 2537–2547. doi:10.1002/cber.188201502213 (德语).
- ^ 96.0 96.1 Meister, G. Production of Rarer Metals (PDF) (报告). United States Atomic Energy Commission. 1948 [2017-09-22].
- ^ 97.0 97.1 97.2 97.3 Leach, M. R. The INTERNET Database of Periodic Tables. [2012-05-14]. (原始内容存档于2012-08-28).
- ^ Jensen, William B. The Place of Zinc, Cadmium, and Mercury in the Periodic Table (PDF). Journal of Chemical Education. 2003, 80 (8): 952–961. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952. (原始内容 (PDF)存档于2010-06-11).
- ^ 99.0 99.1 Masterton, W. L.; Hurley, C. N.; Neth, E. J. Chemistry: Principles and reactions 7th. Cengage Learning. 2011-01-31: 173. ISBN 978-1-111-42710-8.
- ^ Curie, M. Rayons émis par les composés de l'uranium et du thorium [Rays emitted by compounds of uranium and thorium]. Comptes Rendus. 1898, 126: 1101–1103. OL 24166254M (法语).
- ^ Schmidt, G. C. Über die vom Thorium und den Thoriumverbindungen ausgehende Strahlung [On the radiation emitted by thorium and thorium compounds]. Verhandlungen der Physikalischen Gesellschaft zu Berlin (Proceedings of the Physical Society in Berlin). 1898, 17: 14–16 (德语).
- ^ Schmidt, G. C. Über die von den Thorverbindungen und einigen anderen Substanzen ausgehende Strahlung [On the radiation emitted by thorium compounds and some other substances]. Annalen der Physik und Chemie. 1898, 65 (5): 141–151 [2019-08-10]. Bibcode:1898AnP...301..141S. doi:10.1002/andp.18983010512. (原始内容存档于2021-04-28) (德语). (modern citation: Annalen der Physik, vol. 301, pp. 141–151 (1898)).
- ^ Rutherford, E.; Owens, R. B. Thorium and uranium radiation. Trans. R. Soc. Can. 1899, 2: 9–12.: "The radiation from thorium oxide was not constant, but varied in a most capricious manner", whereas "All the compounds of Uranium give out a radiation which is remarkably constant."(“氧化钍的放射并非常数,变化相当剧烈”,反之“所有铀的化合物的放射都非常平稳”)
- ^ Simmons, J. G. The Scientific 100: A Ranking of the Most Influential Scientists, Past and Present. Carol. 1996: 19. ISBN 978-0-8065-2139-8.
- ^ Fröman, N. Marie and Pierre Curie and the Discovery of Polonium and Radium. nobelprize.org. Nobel Media AB. 1996 [2017-05-11]. (原始内容存档于2018-08-07).
- ^ 106.0 106.1 Burns, M. Low-Level Radioactive Waste Regulation-Science, Politics and Fear. CRC Press. 1987: 24–25. ISBN 978-0-87371-026-8.
- ^ van Spronsen, J. W. The periodic system of chemical elements. Elsevier. 1969: 315–316. ISBN 978-0-444-40776-4..
- ^ Rhodes, R. The Making of the Atomic Bomb 25th Anniversary. Simon & Schuster. 2012: 221–222, 349. ISBN 978-1-4516-7761-4.
- ^ Türler, A.; Buklanov, G. V.; Eichler, B.; et al. Evidence for relativistic effects in the chemistry of element 104. Journal of Alloys and Compounds. 1998,. 271–273: 287. doi:10.1016/S0925-8388(98)00072-3.
- ^ Kratz, J. V.; Nagame, Y. Liquid-Phase Chemistry of Superheavy Elements. Schädel, M.; Shaughnessy, D. (编). The Chemistry of Superheavy Elements 2nd. Springer-Verlag. 2014: 335. ISBN 978-3-642-37465-4. doi:10.1007/978-3-642-37466-1.
- ^ 111.0 111.1 111.2 111.3 Furuta, E.; Yoshizawa, Y.; Aburai, T. Comparisons between radioactive and non-radioactive gas lantern mantles. J. Radiol. Prot. 2000, 20 (4): 423–431. Bibcode:2000JRP....20..423F. PMID 11140713. doi:10.1088/0952-4746/20/4/305.
- ^ New Jersey Department of Health. Health and hazardous waste (PDF). A Practitioner's Guide to Patients' Environmental Exposures. 1996, 1 (3): 1–8. (原始内容 (PDF)存档于2016-04-15).
- ^ Toepker, Terrence P. Thorium and yttrium in gas lantern mantles. American Journal of Physics. 1996, 64 (2): 109. Bibcode:1996AmJPh..64..109T. doi:10.1119/1.18463.
- ^ 114.0 114.1 Poljanc, K.; Steinhauser, G.; Sterba, J. H.; et al. Beyond low-level activity: on a "non-radioactive" gas mantle. Science of the Total Environment. 2007, 374 (1): 36–42. Bibcode:2007ScTEn.374...36P. PMID 17270253. doi:10.1016/j.scitotenv.2006.11.024.
- ^ Kazimi, M. Thorium Fuel for Nuclear Energy. American Scientist. 2003 [2017-09-29]. (原始内容存档于2017-01-01).
- ^ Majumdar, S.; Purushotham, D. S. C. Thorium fuel utilization: Options and trends (PDF) (报告). International Atomic Energy Agency. 1999 [2017-10-07]. (原始内容 (PDF)存档于2021-04-12).
|entry=被忽略 (帮助) - ^ Nuclear Power in India. World Nuclear Association. 2017 [2017-09-29]. (原始内容存档于2016-09-06).
- ^ IAEA-TECDOC-1450 Thorium Fuel Cycle – Potential Benefits and Challenges (PDF). International Atomic Energy Agency. 2005 [2009-03-23]. (原始内容 (PDF)存档于2016-08-04).
- ^ Educational Foundation for Nuclear Science, Inc. Bulletin of the Atomic Scientists. : 19–20. ISSN 0096-3402.
- ^ IAEA-TECDOC-1349 Potential of thorium-based fuel cycles to constrain plutonium and to reduce the long-lived waste toxicity (PDF). International Atomic Energy Agency. 2002 [2009-03-24]. (原始内容 (PDF)存档于2021-04-28).
- ^ Evans, B. Scientist urges switch to thorium. ABC News. 2006 [2011-09-17]. (原始内容存档于2010-03-28).
- ^ Martin, R. Uranium is So Last Century – Enter Thorium, the New Green Nuke. Wired. 2009 [2010-06-19]. (原始内容存档于2010-06-26).
- ^ 123.0 123.1 123.2 Thorium. World Nuclear Association. 2017 [2017-06-21]. (原始内容存档于2017-05-08).
- ^ Woods, W. K. LRL Interest in U-233. Battelle Memorial Institute. 1966. OSTI 79078. doi:10.2172/79078 (英语).
- ^ Stoll 2005,第7页.
- ^ United States Geological Survey. Thorium (PDF). 2012 [2017-05-12]. (原始内容 (PDF)存档于2017-04-29).
- ^ K.M.V. Jayaram. An Overview of World Thorium Resources, Incentives for Further Exploration and Forecast for Thorium Requirements in the Near Future (PDF). (原始内容 (PDF)存档于2007-11-28).
- ^ Thorium. Statistics and Information (报告). United States Geological Survey. 2017 [2018-01-06]. (原始内容存档于2019-01-10) (英语).
- ^ 129.0 129.1 129.2 129.3 129.4 129.5 129.6 129.7 Stoll 2005,第8页.
- ^ 130.0 130.1 130.2 130.3 130.4 Stoll 2005,第32页.
- ^ 131.0 131.1 Stoll 2005,第31页.
- ^ Matson, Tim. The Book of Non-electric Lighting: The Classic Guide to the Safe Use of Candles, Fuel Lamps, Lanterns, Gaslights & Fire-View Stoves. Countryman Press. 2011: 60. ISBN 978-1-58157-829-4.
- ^ Shaw, J.; Dunderdale, J.; Paynter, R. A. A Review of Consumer Products Containing Radioactive Substances in the European Union (PDF). NRPB Occupational Services Department. (原始内容 (PDF)存档于2021-03-10).
- ^ Pridham, G. J. Electronic Devices and Circuits: The Commonwealth and International Library: Electrical Engineering Division. Elsevier. 2016: 105. ISBN 978-1-4831-3979-1 (英语).
- ^ Uttrachi, J. Weld Like a Pro: Beginning to Advanced Techniques. CarTech Inc. 2015: 42. ISBN 978-1-61325-221-5.
- ^ Jeffus, L. Welding: Principles and Applications. Cengage Learning. 2016: 393. ISBN 978-1-305-49469-5.
- ^ Oak Ridge Associated Universities. Thoriated Camera Lens (ca. 1970s). 1999 [2017-09-29]. (原始内容存档于2021-04-12).
- ^ Rancourt, J. D. Optical thin films: user handbook. SPIE Press. 1996: 196. ISBN 978-0-8194-2285-9.
- ^ Kaiser, N.; Pulker, H. K. Optical Interference Coatings. Springer. 2013: 111. ISBN 978-3-540-36386-6 (英语).
- ^ Ronen, Y. A rule for determining fissile isotopes. Nuclear Science and Engineering. 2006, 152 (3): 334–335. ISSN 0029-5639. doi:10.13182/nse06-a2588.
- ^ 141.0 141.1 Ronen, Y. Some remarks on the fissile isotopes. Annals of Nuclear Energy. 2010, 37 (12): 1783–1784. doi:10.1016/j.anucene.2010.07.006.
- ^ Plutonium. World Nuclear Association. 2017 [2017-09-29]. (原始内容存档于2017-10-05).
- ^ 143.0 143.1 143.2 Greenwood & Earnshaw 1997,第1259页.
- ^ Interactive Chart of Nuclides. Brookhaven National Laboratory. [2013-08-12]. (原始内容存档于2017-01-24).
- ^ Thorium test begins. World Nuclear News. 2013 [2013-07-21]. (原始内容存档于2013-07-19).
- ^ IAEA-TECDOC-1450 Thorium Fuel Cycle – Potential Benefits and Challenges (PDF). International Atomic Energy Agency. 2005 [2009-03-23]. (原始内容存档 (PDF)于2016-08-04).
- ^ 147.0 147.1 Langford, R. E. Introduction to Weapons of Mass Destruction: Radiological, Chemical, and Biological. John Wiley & Sons. 2004: 85. ISBN 978-0-471-46560-7.
- ^ Stoll 2005,第30页.
- ^ 149.0 149.1 Nakajima, Ts.; Groult, H. Fluorinated Materials for Energy Conversion. Elsevier. 2005: 562–565. ISBN 978-0-08-044472-7.
- ^ Rees, E. Don't believe the spin on thorium being a greener nuclear option. The Guardian. 2011 [2017-09-29]. (原始内容存档于2017-09-27).
- ^ Sovacool, B. K.; Valentine, S. V. The National Politics of Nuclear Power: Economics, Security, and Governance. Routledge. 2012: 226. ISBN 978-1-136-29437-2.
- ^ Nuclear Energy FAQs (PDF). Argonne National Laboratory. 2014 [2018-01-13]. (原始内容存档 (PDF)于2014-10-07).
- ^ Findlay, T. Nuclear Energy and Global Governance: Ensuring Safety, Security and Non-proliferation. Routledge. 2011: 9. ISBN 978-1-136-84993-0.
- ^ 154.0 154.1 154.2 Thorium: Radiation Protection. United States Environmental Protection Agency. [2016-02-27]. (原始内容存档于2006-10-01).
- ^ 155.0 155.1 Radioactivity in Lantern Mantles. Australian Radiation Protection and Nuclear Safety Agency. [2017-09-29]. (原始内容存档于2007-10-14).
- ^ 156.0 156.1 156.2 156.3 Stoll 2005,第35页.
- ^ Natural Decay Series: Uranium, Radium, and Thorium (PDF). Argonne National Laboratory. 2005 [2017-09-30]. (原始内容 (PDF)存档于2016-08-17).
- ^ Luetzelschwab, J. W.; Googins, S. W. Radioactivity released from burning gas lantern mantles. Health Phys. 1984, 46 (4): 873–881. PMID 6706595. doi:10.1097/00004032-198404000-00013.
- ^ Huyskens, C. J.; Hemelaar, J. T.; Kicken, P. J. Dose estimates for exposure to radioactivity in gas mantles. Sci. Total Environ. 1985, 45: 157–164. Bibcode:1985ScTEn..45..157H. PMID 4081711. S2CID 39901914. doi:10.1016/0048-9697(85)90216-5.
- ^ Toxicological Profile for Thorium (PDF). Agency for Toxic Substances and Disease Registry U.S. Public Health Service: 4. 1990 [2024-03-26]. (原始内容存档 (PDF)于2004-10-21).
- ^ Merkel, B.; Dudel, G.; et al. Untersuchungen zur radiologischen Emission des Uran-Tailings Schneckenstein (PDF) (报告). Sächsisches Staatsministerium für Umwelt und Landesentwicklung. 1988. (原始内容 (PDF)存档于2013-01-08) (德语).
- ^ Stoll 2005,第34页.
- ^ Thorium ToxFAQs (PDF). Agency for Toxic Substances and Disease Registry. [2017-09-29]. (原始内容存档 (PDF)于2012-06-05).
- ^ Compendium of Policy And Statutory Provisions Relating To Exploitation of Beach Sand Minerals. Department of Atomic Energy. [2008-12-19]. (原始内容存档于2008-12-04).
- ^ Pfeiffer, W. C.; Penna-Franca, E.; Ribeiro, C. C.; Nogueira, A. R.; Londres, H.; Oliveira, A. E. Measurements of environmental radiation exposure dose rates at selected sites in Brazil. An. Acad. Bras. Ciênc. 1981, 53 (4): 683–691. PMID 7345962.
- ^ Alberici, Emma. Italian military officials' trial ignites suspicions of links between weapon testing and birth defects in Sardinia. ABC News (Australian Broadcasting Corporation). 2019-01-29 [2019-01-29]. (原始内容存档于2019-01-29).
参考书目
[编辑]- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Butterworth-Heinemann. 1997. ISBN 978-0-08-037941-8.
- Stoll, W. Thorium and Thorium Compounds. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. 2005. ISBN 978-3-527-31097-5. doi:10.1002/14356007.a27_001.
- Wickleder, M. S.; Fourest, B.; Dorhout, P. K. Thorium. Morss, L. R.; Edelstein, N. M.; Fuger, J. (编). The Chemistry of the Actinide and Transactinide Elements (PDF) 3 3rd. Springer-Verlag. 2006: 52–160. ISBN 978-1-4020-3598-2. doi:10.1007/1-4020-3598-5_3. (原始内容 (PDF)存档于2017-12-14).
延伸阅读
[编辑]- Martin, Richard. Super Fuel: Thorium, the Green Energy Source for the Future 1st. Palgrave Macmillan. 2012: 240. ISBN 978-0-230-11647-4.
- Hargraves, Robert. Thorium: Energy Cheaper than Coal. CreateSpace Independent Publishing Platform. 2012-07-25: 482. ISBN 978-1478161295.
外部链接
[编辑]- 元素钍在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 钍(英文)
- 元素钍在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素钍在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 钍(英文)
- International Thorium Energy Organisation – IThEO.org
- European Nuclear Society – Natural Decay Chains
- ATSDR CDC ToxFAQs: health questions about thorium
- FactSheet on Thorium (页面存档备份,存于互联网档案馆), World Nuclear Association
- Thorium TV – A review of the element
- EnergyFromThorium.com – Content-rich site on Thorium as a future energy source, and its extraction technology (页面存档备份,存于互联网档案馆)
- TED talk by former NASA engineer Kirk Sorensen about Thorium energy production (video) (页面存档备份,存于互联网档案馆)
- India's experimental Thorium Fuel Cycle Nuclear Reactor (NDTV Report) (页面存档备份,存于互联网档案馆)
- Thorium Remix 2011 – 120 minute Creative Commons Share-Alike documentary on Thorium as an energy source (页面存档备份,存于互联网档案馆)
- Newspaper article about thorium power in India (页面存档备份,存于互联网档案馆)
- China Blazes Trail for Clean Nuclear Power from Thorium (页面存档备份,存于互联网档案馆)
- Thorium (页面存档备份,存于互联网档案馆) at The Periodic Table of Videos (University of Nottingham)
- Thorium Deposits of the United States—Energy Resources for the Future? (页面存档备份,存于互联网档案馆) (USGS, 2009)
- 钍




