瀰漫性泛細支氣管炎
| 瀰漫性泛細支氣管炎 | |
|---|---|
 | |
| 圖為一名患有瀰漫性泛細支氣管炎16歲男孩的下胸部高解析度電腦斷層掃描 | |
| 類型 | rare genetic respiratory disease[*]、肺病[*] |
| 分類和外部資源 | |
| 醫學專科 | 胸腔醫學 |
| ICD-11 | CA26.1 |
| ICD-10 | J21.9 |
| ICD-9-CM | 466.1 |
| OMIM | 604809 |
| DiseasesDB | 3804 |
| Orphanet | 171700 |
瀰漫性泛細支氣管炎(英語:Diffuse panbronchiolitis,縮寫:DPB)是一種未知成因的炎性肺病。它是一種嚴重的進行性細支氣管炎,而細支氣管炎就是指細支氣管(肺部內細小的空氣管道)出現發炎症狀。病症名稱中的「瀰漫性」指的是兩個肺部到處都是病灶,而「泛細支氣管炎」指的是呼吸細支氣管(參與氣體交換的細支氣管)的各層都出現了發炎。這種病會導致嚴重的發炎和終端細支氣管出現類似結節的病灶、慢性鼻竇炎,以及咳出大量痰的劇烈咳嗽。
據信這種病的出現是由於身體對引起這種病的細菌或病毒有感受性,或是免疫系統對此沒有抵抗性,而上述問題是由幾個基因所引起的,這幾種基因主要出現在東亞人種之中。患病率最高的是日本人,其次是朝鮮人。男性的患病率較高,通常約在四十歲時開始患病。它在1960年代初被確認為一種相異的新病症,到1969年被正式命名為「瀰漫性泛細支氣管炎」。
瀰漫性泛細支氣管炎在沒有治療的情況下會演變成支氣管擴張症,這種不可逆的肺部症狀包括細支氣管變粗,以及細支氣管通道內黏液淤積。患者可透過每天服用如紅黴素的大環內酯抗生素來減輕症狀和延長存活時間,但這種病目前無法治癒。它可最終演變成呼吸衰竭或心臟問題。
分類
[編輯]「細支氣管炎」一詞一般指的是細支氣管的炎症[1]。瀰漫性泛細支氣管炎的分類為「原發性細支氣管炎」[1],即是說引起細支氣管炎的根本原因是從細支氣管而來,又或是患病區域僅限於細支氣管[2][3]。除此病以外,其他形式的基本細支氣管炎還包括閉塞性細支氣管炎、濾泡性細支氣管炎、呼吸性細支氣管炎及礦物粉塵氣道疾病等疾病[2]。與瀰漫性泛細支氣管炎不同的是,不被視為具「原發性」的細支氣管炎會與較大氣道的疾病相關,例如慢性支氣管炎[2][3]。
體徵與症狀
[編輯]瀰漫性泛細支氣管炎的症狀包括慢性鼻竇炎(紅腫的鼻竇)、喘鳴、囉音(由肺部中如痰及分泌等阻塞造成的呼吸音)、呼吸困難,以及咳出大量痰的劇烈咳嗽。痰中可能有膿,患者可能會發熱。此病進行性的典型體徵為細支氣管通道擴張及低血氧症(血液含氧水平低下)。若此病未被治療,則會造成支氣管擴張症;特徵是細支氣管擴張和管壁變厚、呼吸性和終端性細支氣管受到炎症傷害,以及肺部有黏液淤積[4][5]。這種病與進行性呼吸衰竭和高碳酸血症(血液含二氧化碳水平高企)有關,甚至可以導致肺動脈高血壓和肺心病(右心室擴張或右心臟衰竭)[6][7]。
成因
[編輯]
瀰漫性泛細支氣管炎是一種特發病,即是說它的生理、環境及病原體成因仍是未知的。然而,已知有幾個因素有可能與致病機制有關[4]。
主要組織相容性複合體(MHC)是存在於大部份脊椎動物的一個基因家族,與免疫系統相關。其中人類的位於6號染色體上。當中一部份為人類白細胞抗原(HLA),負責控制抗原呈現系統,是人類對付如細菌和病毒等病原體的後天免疫系統的一部份。當人類細胞受到病原體感染時,它們能在它們的表面上呈現部份病原體蛋白質;這就是「抗原呈現」。受感染的細胞因此成為細胞毒性T細胞的攻擊對象,它們會把受感染的細胞殺死,並將它們從體內移除[8]。
瀰漫性泛細支氣管炎感病性的遺傳預先傾向性已被局限於兩個常見於東亞血統的人類白細胞抗原單倍型(成對染色體之間不同的一個核苷酸或一段基因序列,在同一種族或同一性狀中較有可能出現)。HLA-B54與日本人的瀰漫性泛細支氣管炎有關,而HLA-A11則與朝鮮人的此病有關[9]。第一型人類白細胞抗原內這區間的數個基因被認為是與瀰漫性泛細支氣管炎有關,導致感病性因而提高擁有者患上這個病的機會[7][10]。在研究瀰漫性泛細支氣管炎的基因時有考慮到日本和朝鮮患者的共同遺傳背景和相近的人類白細胞抗原輪廓[10]。有學者提出在HLA-B[11]與HLA-A[12]間某處的可能感病性基因曾經在同時擁有HLA-B54及HLA-A11的遠祖染色體上發生突變。而且在該疾病基因座(染色體上的位置)附近可能發生過數宗遺傳重組事件,因而導致該病與日本人的HLA-B54和朝鮮人的HLA-A11有關。在繼續研究之下,結論為這種病的感病性基因的位置為位於染色體6p21.3的HLA-B基因座附近。這種病的遺傳成因搜尋就在這個區域內繼續進行中[9][10]。
由於不少屬於人類白細胞抗原的基因仍未被識別,因此曾經使用過定位克隆法(一種用於染色體位置已知的基因識別方法)來斷定一種類似黏液素的基因與瀰漫性泛細支氣管炎有關。除此之外,研究者們已經調查過瀰漫性泛細支氣管炎區域內的已識別人類白細胞抗原基因所導致的疾病。其中一種叫第一型裸淋巴細胞綜合症(BLS I),與瀰漫性泛細支氣管炎有數個相似症狀,包括慢性鼻竇炎、細支氣管發炎和出現結節,以及出現流感嗜血桿菌。還有一點與瀰漫性泛細支氣管炎相似,第一型裸淋巴細胞綜合症對紅黴菌療程的反應有效,出現症狀舒緩。這兩種病的相似症狀、對同樣治療的對應成功,以及第一型裸淋巴細胞綜合症的致病基因就在人類白細胞抗原基因的瀰漫性泛細支氣管炎致病區域這點,使得研究者收窄了確立瀰漫性泛細支氣管炎致病基因的範圍[9]。雖然一般不認為諸如吸入有毒煙霧或吸煙的環境因素對這種病起到作用,但是現時並未被排除未知的環境原因及其他非遺傳原因——例如尚未識別的細菌或病毒[4][6][7]。
囊腫性纖維化(CF)是一種進行性多系統肺病,可用於研究瀰漫性泛細支氣管炎的遺傳成因。這是有數個原因的。囊腫性纖維化跟瀰漫性泛細支氣管炎一樣的是會引起肺部嚴重發炎、黏液大量生產、感染,而且都對某一地區族群的人有遺傳預先預向性,其他人很少會患;其中瀰漫性泛細支氣管炎主要發生在東亞人身上,而囊腫性纖維化則主要影響有歐洲血統的人。現時還未有牽涉引起瀰漫性泛細支氣管炎的基因,已知囊腫性纖維化由某個基因的異變引起,而這個異變在歐洲人種身上發生的機會要比其他人種高很多。這個在引起囊腫性纖維化的基因上的突變並不是導致瀰漫性泛細支氣管炎的因素,但是已知這個基因有一種特殊的多態性(變異),它會出現在不少沒有患上這兩種病的亞洲人身上。現時研究正在調查這個基因是否有任何能導致瀰漫性泛細支氣管炎的異變態[4][9]。
病理生理學
[編輯]發炎是人類免疫系統正常反應的一部份,為此包括中性粒細胞(專門引起發炎的白血球)的白血球集結,以及趨化因子(由某些細胞釋放的蛋白質,負責啟動或引出其他細胞的反應)在體內任何發生細菌或病毒感染的地方積累。發炎干預了細菌及病毒的行動,並負責將它們從體內移除。流感嗜血桿菌和綠膿桿菌在瀰漫性泛細支氣管炎中能夠導致發炎細菌向細支氣管組織增生。然而在這兩種細菌都不在的瀰漫性泛細支氣管炎中,炎症依然會因為現時未知的原因繼續下去[4][5]。在上述的任一種情況中,這種病的發炎可以嚴重到使得含有發炎細胞的結節在細支氣管的管壁生長[4][13]。氣道中的發炎和感染也導致黏液的過量生產,這些黏液必須要以痰的方式咳出[4][6]。炎症、結節發育、感染、黏液和咳嗽頻密,就是這個組合構成了瀰漫性泛細支氣管炎的呼吸困難[4][5]。
瀰漫性泛細支氣管炎可以含有或不含有流感嗜血桿菌和綠膿桿菌這一點,能為判定致病機制中的數項機制提供方法[5]。白三烯是一種類花生酸,而類花生酸是一種由必需脂肪酸所造的脂質信號傳送分子,白三烯在多種肺病中起到作用,因為它負責引起氣道中的發炎細胞增生和黏液過量生產[14]。在瀰漫性泛細支氣管炎及其他肺病中,中性粒細胞相關發炎的主要媒介是白三烯B4,它是專門透過趨化性(幾種細胞趨進或遠離某些化學物質的運動)引起中性粒細胞增生的[4][9]。
趨化因子MIP-1α 以及受它牽連的CD8+T細胞也會引起瀰漫性泛細支氣管炎的炎症。若如綠膿桿菌的致病原有出現的話,則這種病的後續炎症是由β防禦素所引起的,它是一類出現於呼吸道的抗微生物肽。若此病有逆轉錄病毒第一型人類T淋巴細胞病毒出現的話,則它會透過感染輔助型T細胞並改變它們對此病已知和未知致病原的辨認效率,來改變此病的致病機制[4][9]。
診斷
[編輯]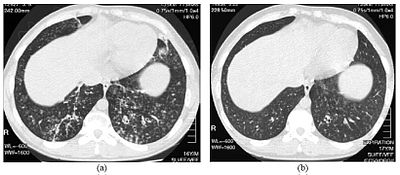
要診斷瀰漫性泛細支氣管炎,需要分析肺部及細支氣管的組織,因此需要用到肺部的活體組織切片或較常採用的高解析度電腦斷層掃描[7]。診斷準別包括呼吸細支氣管各層都嚴重發炎,以及兩邊肺部的呼吸細支氣管和終端細支氣管都出現結節狀的肺組織病灶[4]。瀰漫性泛細支氣管炎的結節在X射線肺部成像中看起來就是不透明的塊狀物,它們可以引起氣道阻塞,其情形可由肺功能測試(PFT)得知[6]。從肺部X射線成像還可以看出另一項瀰漫性泛細支氣管炎的病徵——細支氣管通道的擴張。高解析度電腦斷層掃描常常會展示出被黏液堵塞的細支氣管,這種圖像樣式被稱為「樹芽徵」[7]。另一項呼吸困難的體徵——低氧血症,可通過量度動脈血中含氧量和二氧化碳量來確診。其他對瀰漫性泛細支氣管炎的觀察還包括肺部的淋巴細胞(對抗感染的白血球)、中性粒細胞及肺部內腔的泡沫組織細胞(組織巨噬細胞)出現增生的情況。也可以檢測到流感嗜血桿菌及綠膿桿菌,其中後者會隨着病症加深而變得明顯[4][5]。全血細胞計數(CBC)可以量度出血液白血球、細菌及血液內其他細胞的數量。免疫球蛋白G和免疫球蛋白A(免疫球蛋白的分類)的水平可能會提高,並出現類風濕因子(自體免疫的標識)。可能會出現血球凝集,這是紅血球因血液中出現抗體作出反應而造成的凝集。注射入細支氣管氣道後然後被移除的支氣管肺泡灌洗液可以用作瀰漫性泛細支氣管炎的評估,由患者的灌洗液中會偵測到中性粒細胞、β防禦素、白三烯和趨化因子[4][9]。
鑑別診斷
[編輯]在一些阻塞性肺病的鑑別診斷(在特徵重合的病症中找出正確的診斷)中,往往都會考慮到瀰漫性泛細支氣管炎。這種病的不少病徵都與其他阻塞性肺病類似,例如哮喘、慢性支氣管炎及肺氣腫。喘鳴、咳嗽痰多和氣促都是這些病普遍病徵,肺功能測試可以測出阻塞性呼吸功能受損[6]。跟瀰漫性泛細支氣管炎一樣,囊腫性纖維化也會導致肺部嚴重發炎、黏液過量生產,以及感染;但前者不會像後者那樣干擾胰臟功能或電解質的平衡,因此這兩種病大概沒有關聯[4][9]。瀰漫性泛細支氣管炎最大的特點就是在X射線成像中會有結節狀的病灶出現於左右肺部的細支氣管;呼吸性細支氣管的各組織層都會出現發炎症狀;並且東亞血統的患病率較高[4]。
瀰漫性泛細支氣管炎和閉塞性細支氣管炎是兩種原發性細支氣管炎[2]。這兩種的重合特徵包括帶大量痰(時常滿是膿)的劇烈咳嗽、下支氣管及細支氣管區域在肺部X射線成像中有可見的結節,及慢性鼻竇炎。瀰漫性泛細支氣管炎的結節比較局限於呼吸性細支氣管,而閉塞性細支氣管炎的結節則常出現於膜細支氣管(從末端支氣管分出來的非軟骨細支氣管開始部份)至次支氣管之間。閉塞性細支氣管炎是一種世界性的細支氣管疾病,而瀰漫性泛細支氣管炎則比較有地區性,主要是日本[2][6]。在近年對瀰漫性泛細支氣管炎的臨床識別之前,此病常被誤診為支氣管擴張症、慢性阻塞性肺病、特發性肺纖維化、粟粒性肺結核、結節病或細支氣管肺泡癌[15]。
治療
[編輯]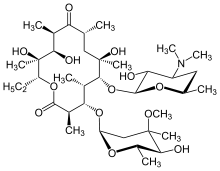
持續定時服用如紅黴素的大環內酯抗生素能有效對付瀰漫性泛細支氣管炎[16][17]。克拉黴素和羅紅黴素也普遍用作治療此病[18]。大環內酯能能治療此病及其他相似肺病,是因為小劑量服用這種抗生素能調節免疫反應,從而達到控制症狀的效果[17]。治療為每天口服紅黴素[7]兩至三年,因為已經證實了這種長度的長期服用能大幅度提升治療效果。這點在接受治療中的患者中尤其明顯:在多種病情減緩標準中,支氣管肺泡灌洗液中的中性粒細胞數目正常,而且動脈血中含氧量(量度動脈中血氧及二氧化碳含量的血液檢查)的讀數指出血中自由氧的水平在正常範圍之內[16][17][19]。建議在這些情況下准許患者暫時停止治療,以減低出現綠膿桿菌的機會,因為綠膿桿菌具大環內酯抗性[16]。然而,瀰漫性泛細支氣管炎的症狀一般會復發,因此有重新開始治療的必要。儘管紅黴素非常有效,但是不是在所有患者身上都成功,尤其是出現了具大環內酯抗性的綠膿桿菌,或之前未接受治療的患者已惡化到出現呼吸衰竭[17][19]。
在紅黴素治療中,通過抑制中性粒細胞增生、白血球活動,以及氣道中的阻塞性黏液和水分泌,來大幅減少細支氣管的發炎和損害[16]。大環內酯的抗生素反應與其減輕此病發炎症狀的有用效果無關[19]。這一點實際上是明顯的,因為治療用的低劑量根本不足以對抗感染,而且如果患者受到具大環內酯抗性旳綠膿桿菌感染,紅黴素療依然能減輕炎症[16]。
用紅黴素或其他大環內酯來壓抑炎症時有幾個因素。它們對於抑制中性粒細胞增生非常有效,因為它們能夠減低白細胞介素-8和白三烯B4吸引中性粒細胞的能力[20]。大環內酯還能夠減低黏附分子的有效性,使得中性粒細胞不能像平時那樣黏附於細支氣管的組織內層。氣道中的黏液生產是瀰漫性泛細支氣管炎及其他呼吸道疾病致病和致命的主要元兇。以大幅減輕此病發炎而著稱的紅黴素療法也能幫助抑制黏液的生產過盛[20]。
預後
[編輯]未經治療的瀰漫性泛細支氣管炎可演變成支氣管擴張症、呼吸系統衰竭,甚至死亡。一份1983年的學術報告指出,未經治療的瀰漫性泛細支氣管炎患者5年存活率為62.1%,10年存活率為33.2%[6]。由於患者接受過紅黴素治療後,會有較佳的症狀管理、延緩進行性及預防如綠膿桿菌的相關感染,所以其預期壽命被未經治療的要長得多[19]。經治療的患者10年存活率約為90%[4]。治療有時需要進行兩年才有顯着成效,而治療後有顯著改善的個案是可以獲准暫停治療一段時間的。不過患者在暫停治療期間需要接受密切的監督。由於已經證實了此病是會復發的,因此症狀再度出現就必需立即重新開始紅黴素療治。儘管治療後的預後已得到了改善,但是瀰漫性泛細支氣管炎目前仍是無法治癒的[4][9]。
流行病學
[編輯]瀰漫性泛細支氣管炎患病率最高的是日本人,其人口每十萬就有11人患上此病[4]。朝鮮人[21]、中國人[22]和泰國人[23]之中也有確診個案。這意味着東亞人種對這種病有遺傳預先傾向性[9]。這種病在男性中比較普遍[24],患者的男女比例為1.24至2比1(或約為5比3)[4]。患者的平均病發年齡為40歲,三分之二為非吸煙者,儘管現時並不認為吸煙是此病的成因[7]。若有HLA-Bw54的話,則患此病的風險提升13.3倍[25]。
瀰漫性泛細支氣管炎在歐洲和美洲的病例相對較少,當中包括亞洲的移民和居民,以及亞洲裔以外的個體[26][27][28]。西方對這種病的認知與亞洲國家相比相對不足,因此曾經發生過誤診的情況。此病在西方的已知病例數相對於大量居住於西方的亞洲人口是少的,因此意味着非遺傳因素可能也影響到此病的成因。西方亞洲人中的病例罕見的這一點某程度上也有可能是因為誤診的緣故[7][29]。
歷史
[編輯]日本的一群醫生在1960年代初觀察到一種相對地新的慢性肺病,並對此作出描述。為了與慢性支氣管炎、肺氣腫、肺泡炎及其他有發炎症狀的阻塞性肺病區分開來,這種肺病於1969年被命名為「瀰漫性泛細支氣管炎」[30]。日本政府厚生省於1978至1980年間的全國調查揭發出超過一千宗瀰漫性泛細支氣管炎的可能個案,其中82宗已經由肺組織確診。世界各國在1980年代承認了這種病是一種相異的肺病[4][6]。
瀰漫性泛細支氣管炎的預後及期望結果在1980年代之前都相當差,尤其是綠膿桿菌的二重感染個案(除了現時發生的感染,另外還出現了新的病毒或細菌感染)[13]。在抗生素療法通用之前,這種病的死亡率一直都非常高,而氧氣療法正開始成為管理症狀的例行手法。當使用抗生素紅黴素的長期療法於1985年成為了管理這種病的標準手法之後,預後就有了顯著的改善[19]。這種病與HLA有關聯的主張最初在1990年出現[9]。
參考文獻
[編輯]- ^ 1.0 1.1 Visscher, D. W.; Myers, J. L. Bronchiolitis: the pathologist's perspective (Free full text). Proceedings of the American Thoracic Society. 2006, 3 (1): 41–47 [2021-09-11]. PMID 16493150. doi:10.1513/pats.200512-124JH. (原始內容存檔於2010-04-16).
- ^ 2.0 2.1 2.2 2.3 2.4 Ryu, J. H.; Myers, J. L.; Swensen, S. J. Bronchiolar disorders (Free full text). American Journal of Respiratory and Critical Care Medicine. Dec 2003, 168 (11): 1277–1292 [2021-09-11]. PMID 14644923. doi:10.1164/rccm.200301-053SO. (原始內容存檔於2009-12-02).
- ^ 3.0 3.1 Ryu, J. H. Classification and approach to bronchiolar diseases. Current Opinion in Pulmonary Medicine. Mar 2006, 12 (2): 145–151. PMID 16456385. doi:10.1097/01.mcp.0000208455.80725.2a.
- ^ 4.00 4.01 4.02 4.03 4.04 4.05 4.06 4.07 4.08 4.09 4.10 4.11 4.12 4.13 4.14 4.15 4.16 4.17 4.18 4.19 Poletti, V.; Casoni, G.; Chilosi, M.; Zompatori, M. Diffuse panbronchiolitis (Free full text). European Respiratory Journal. Oct 2006, 28 (4): 862–871 [2021-09-11]. PMID 17012632. doi:10.1183/09031936.06.00131805. (原始內容存檔於2020-09-01).
- ^ 5.0 5.1 5.2 5.3 5.4 Yanagihara, K.; Kadoto, J.; Kohno, S. Diffuse panbronchiolitis—pathophysiology and treatment mechanisms. International Journal of Antimicrobial Agents. 2001,. 18 Suppl 1: S83–S87. PMID 11574201.
- ^ 6.0 6.1 6.2 6.3 6.4 6.5 6.6 6.7 Hiomi Homma, Akira Yamanaka, Shinichi Tanimoto, Masashi Tamura, Yoichi Chijimatsu, Shiro Kira, Takahide Izumi. Diffuse Panbronchiolitis. Chest: 63–69. [2018-04-02]. doi:10.1378/chest.83.1.63. (原始內容存檔於2021-04-05).
- ^ 7.0 7.1 7.2 7.3 7.4 7.5 7.6 7.7 Anthony, M.; Singham, S.; Soans, B.; Tyler, G. Diffuse panbronchiolitis: not just an Asian disease: Australian case series and review of the literature (Free full text). Biomedical Imaging Intervention Journal. Oct 2009, 5 (4): e19. PMC 3097723
 . PMID 21610988. doi:10.2349/biij.5.4.e19.
. PMID 21610988. doi:10.2349/biij.5.4.e19.
- ^ Morris, Alan George; Hewitt, C.; Young, Stephen. The major histocompatibility complex: its genes and their roles in antigen presentation 15. Pergamon. 1994.
|issue=被忽略 (幫助) - ^ 9.00 9.01 9.02 9.03 9.04 9.05 9.06 9.07 9.08 9.09 9.10 Keicho, N.; Hijikata, M. Genetic predisposition to diffuse panbronchiolitis (Free full text). Respirology. May 2011, 16 (4): 581–588 [2021-09-11]. PMID 21303426. doi:10.1111/j.1440-1843.2011.01946.x. (原始內容存檔於2016-03-04).
- ^ 10.0 10.1 10.2 OMIM Panbronchiolitis, Diffuse -604809 Retrieved 11 November 2011.
- ^ OMIM Human Leukocyte Antigen B -142830 Retrieved 21 September 2011.
- ^ OMIM Human Leukocyte Antigen A -142800 Retrieved 21 September 2011.
- ^ 13.0 13.1 Azuma, A.; Kudoh, S. Diffuse panbronchiolitis in East Asia (Free full text). Respirology (Carlton, Vic.). May 2006, 11 (3): 249–261 [2021-09-11]. PMID 16635082. doi:10.1111/j.1440-1843.2006.00845.x. (原始內容存檔於2014-11-23).
- ^ Busse, W. W. Leukotrienes and inflammation (Free full text). American Journal of Respiratory Critical Care Medicine. Jun 1998, 157 (6 pt. 1): S210–S213 [2021-09-11]. PMID 9620941. doi:10.1164/ajrccm.157.6.mar-1. (原始內容存檔於2007-05-10).
- ^ Huiping Li, Ying Zhou, Feng Fan, Yuan Zhang, Xia Li, Hui Yu, Lan Zhao, Xianghua Yi, Guojun He, Jiro Fujita, Dianhua Jiang. Effect of Azithromycin on Patients with Diffuse Panbronchiolitis: Retrospective Study of 51 Cases. Internal Medicine. 2011, 50 (16): 1663–1669 [2018-04-02]. ISSN 0918-2918. doi:10.2169/internalmedicine.50.4727 (英語).
- ^ 16.0 16.1 16.2 16.3 16.4 Kanoh, S.; Rubin, B. K. Mechanisms of Action and Clinical Application of Macrolides as Immunomodulatory Medications. Clinical Microbiology Reviews (Free full text). Jul 2010, 23 (3): 590–615. PMC 2901655
 . PMID 20610825. doi:10.1128/CMR.00078-09.
. PMID 20610825. doi:10.1128/CMR.00078-09.
- ^ 17.0 17.1 17.2 17.3 Lopez-Boado, Y. S.; Rubin, B. K. Macrolides as immunomodulatory medications for the therapy of chronic lung diseases. Current Opinion in Pharmacology. Jun 2008, 8 (3): 286–291. PMID 18339582. doi:10.1016/j.coph.2008.01.010.
- ^ Keicho, N.; Kudoh, S. Diffuse panbronchiolitis: Role of macrolides in therapy. American Journal of Respiratory Medicine. 2002, 1 (2): 119–131. PMID 14720066. doi:10.1007/BF03256601.
- ^ 19.0 19.1 19.2 19.3 19.4 Schultz, M. J. Macrolide activities beyond their antimicrobial effects: macrolides in diffuse panbronchiolitis and cystic fibrosis (Free full text). Journal of Antimicrobial Chemotherapy. Jul 2004, 54 (1): 21–28. PMID 15190022. doi:10.1093/jac/dkh309.
- ^ 20.0 20.1 Tamaoki, J.; Kadota, J.; Takizawa, H. Clinical implications of the immunomodulatory effects of macrolides. The American Journal of Medicine. Nov 2004,. 117 Suppl 9A (9): 5S–11S. PMID 15586558. doi:10.1016/j.amjmed.2004.07.023.
- ^ Kim, Y. W.; Han, S. K.; Shim, Y. S.; Kim, K. Y.; Han, Y. C.; Seo, J. W.; Im, J. G. The first report of diffuse panbronchiolitis in Korea: five case reports. Internal Medicine (Tokyo, Japan). 1992, 31 (5): 695–701. PMID 1504438. doi:10.2169/internalmedicine.31.695.
- ^ Chen, Y.; Kang, J.; Li, S. Diffuse panbronchiolitis in China. Respirology. Jan 2005, 10 (1): 70–75. PMID 15691241. doi:10.1111/j.1440-1843.2005.00622.x.
- ^ Chantarotorn, S.; Palwatwichai, A.; Vattanathum, A.; Tantamacharik, D. Diffuse panbronchiolitis, the first case reports in Thailand. Journal of the Medical Association of Thailand. Aug 1999, 82 (8): 833–838. PMID 10511794.
- ^ Høiby, N. Diffuse panbronchiolitis and cystic fibrosis: East meets West (Free full text). Thorax. Jun 1994, 49 (6): 531–532. PMC 474936
 . PMID 8016786. doi:10.1136/thx.49.6.531.
. PMID 8016786. doi:10.1136/thx.49.6.531.
- ^ Lazarus SC. Murray and Nadel's Textbook of Respiratory Medicine 4th. WB Saunders. 2005: 1300. ISBN 0-7216-0327-0.
- ^ Fitzgerald, J. E.; King Jr, T. E.; Lynch, D. A.; Tuder, R. M.; Schwarz, M. I. Diffuse panbronchiolitis in the United States. American Journal of Respiratory and Critical Care Medicine. Aug 1996, 154 (2 Pt 1): 497–503. PMID 8756828. doi:10.1164/ajrccm.154.2.8756828.
- ^ Martinez, J. A.; Guimarães, S. M.; Ferreira, R. G.; Pereira, C. A. Diffuse panbronchiolitis in Latin America. The American Journal of the Medical Sciences. Mar 2000, 319 (3): 183–185. PMID 10746829. doi:10.1097/00000441-200003000-00008.
- ^ Sandrini, A.; Balter, M. S.; Chapman, K. R. Diffuse panbronchiolitis in a Caucasian man in Canada. Canadian Respiratory Journal : journal of the Canadian Thoracic Society. Nov–Dec 2003, 10 (8): 449–451. PMID 14679410.
- ^ Brugiere, O.; Milleron, B.; Antoine, M.; Carette, M. F.; Philippe, C.; Mayaud, C. Diffuse panbronchiolitis in an Asian immigrant (Free full text). Thorax. Oct 1996, 51 (10): 1065–1067. PMC 472677
 . PMID 8977613. doi:10.1136/thx.51.10.1065.
. PMID 8977613. doi:10.1136/thx.51.10.1065.
- ^ Yamanaka, A.; Saiki, S.; Tamura, S.; Saito, K. Problems in chronic obstructive bronchial diseases, with special reference to diffuse panbronchiolitis. Naika. Mar 1969, 23 (3): 442–451. PMID 5783341 (日語).
參見
[編輯]
