氟化合物

氟可以形成很多化合物,但裡面的氟原子的氧化態基本為 −1。它會和其它原子成鍵,形成極性共價鍵或離子鍵。氟肯定只能形成一個單鍵,儘管有至少兩個X-氟鍵的鍵級超過1的情況(一氟化硼和一氟化氮)。[2]在某些配位分子中,氟離子可能充當兩種金屬之間的橋連配體。含氟分子也可能表現出氫鍵(與某些非金屬的較弱橋鍵)。[3]氟化學涉及和氫、非金屬、金屬甚至惰性氣體形成的化合物,還有一系列有機化合物。[note 1] 大部分元素 (不過不是全部)的最高價態都可以由氟化物達成。一些元素的最高價態只能由氟化物達成,另一些則是由氧化物,還有一些元素的最高價氟化物和氧化物的價態是一樣的。(參見#元素最高氧化態:氟化物vs氧化物)[4]
氟氣
[編輯]一個氟原子有一個不成對的電子,而氟氣分子(F2)沒有不成對的電子。這使得它是反磁性(被磁鐵稍微排斥)的,磁化率為−1.2×10−4(SI),接近理論上的預測。[5]用氧氣分子來對比,它有兩個不成對的電子,使它是順磁性(被磁鐵吸引)的。[6]
| X | XX | HX | BX3 | AlX3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| I | 151 | 294 | 272 | 285 | 239 |
相較於更重的鹵素雙原子分子,氟氣中氟–氟鍵的鍵能較弱。它的鍵能比Cl2或 Br2分子低,這點與同個周期的過氧化物的氧–氧鍵和肼里的氮–氮鍵類似。[8]F2分子的氟的共價半徑是71皮米,大於其它化合物中的數據,這是因為兩個氟原子之間的吸引力較弱,[9]由較大的電子和核間斥力以及原子的小尺寸而產生的鍵分子軌道的相對小的重疊的結果。[10]
F2里只形成一個鍵(換句話說,它的鍵級只有1),由p電子對組成,和其它鹵素分子X2一樣。但是,其它鹵素的p軌道混雜了一點d軌道電子,使鍵級增大。舉個例子,氯氣的鍵級為1.12。[11]氟的電子不能顯示此特性,因為沒有這樣的d軌道在能量上接近氟的價軌道。[11]這也可以解釋為什麼F2比 Cl2弱。[10]此外,F2中的鍵級實際上小於1,因為它的p電子軌道與s軌道的混合很小,而s軌道不參與鍵合。[12]
反應性
[編輯]物質和氟元素的反應是很快且爆炸性的。大部分物質是非活性的,諸如粉狀鋼,玻璃碎片和石棉纖維之類的物質很容易和冷的氟氣反應。木材,甚至水在受到氟射流的刺激下,無需產生火花就可以直接燃燒。[13][14]
| 外部影片連結 | |
|---|---|
氟和銫的反應,由皇家機構拍攝。 (兩個視頻都是在萊斯特大學的氟實驗室拍攝的。) |
氟和金屬的反應劇烈度就看那個金屬是什麼。一般來說,金屬 (例如鋁、鐵和銅) 需要被磨成粉末,不然就會被鈍化,也就是形成一層氟化物保護層來抵禦金屬的進一步氟化。[7]鹼金屬和氟氣反應會發生爆炸,而鹼土金屬的反應速度沒那麼快。抗腐蝕金屬如:釕、銠、鈀、鉑和金要在 300–450 °C (575–850 °F) 下才能和氟氣反應。[15]
氟和氫氣會發生爆炸性反應,就像和鹼金屬反應一樣。[16]鹵素會和氟氣反應[17],重惰性氣體氡也是如此。[18]較輕的惰性氣體氙和氪要在特殊情況下反應,而氬只和氟化氫在極低溫下反應。[19]氮氣,有非常穩定的三鍵,需要放電和高溫才能與氟結合。[20] 氟會和氨反應,形成氮氣和氟化氫。
對分子的影響
[編輯]氟的化學作用主要由其獲得電子的強烈趨勢決定。它是元素電負性最大的,單質氟的氧化性也非常強。把氟的一個電子電離需要很大的能量,已知沒有試劑可以氧化氟,形成正氧化態。[21]
因此,氟的唯一氧化態為−1。唯一的非負氟化合物是氟氣,氧化態為0。此外,氟還可以形成氧化態分別為-½和-⅓的F−
2和F−
3,它們在低溫下穩定,40 K下分解。[22]此外F+
4陽離子還有其衍生物預測是穩定的。[23]
氟已知可以和除了氖和氦以外的所有元素形成化合物。如果只算氟的二元化合物,也就是氟化物的話,那剛才所說的元素都有氟化物,除了氬。前99個元素都有已知的氟化物,除了放射性極強的砹和鍅,還有惰性的氦、氖和氬。[24]氟也可以和101號元素鍆、[25]104號元素鑪[26]和106號元素𨭎形成化合物。[27]
作為分子的一部分,氟可以引發很強的誘導效應。由於這個原因,用氟代替氫的酸的酸性會更強。舉個例子,乙酸和它的氟衍生物:一氟、二氟和三氟衍生物以及它們的pKa值分別是4.74、2.66、1.24和0.23[note 2][28]。也就是說,三氟乙酸的酸性比乙酸強33,800倍。[29]氟是已知最強酸—氟銻酸H
2FSbF
6的重要成分。[30]有證據表明H
2FAuF
6更強,但是它仍未被分離,也未測得酸性。[31]
氟化氫和氫氟酸
[編輯]| HF 和 H2O 的相似性 | |

|

|
| 鹵化氫(藍)和氧族元素的氫化物(紅)的沸點: HF 和 H2O 打破了沸點升高的趨勢,這是因為它們形成了氫鍵。 | HF/ H2O 混合物的凝固點 |
氟會和氫反應,形成氟化氫 (HF) ,而它的水溶液叫氫氟酸。H-F 鍵是少數能夠形成氫鍵的鍵之一。這個性質會影響氟化氫的特性。由於氫鍵,氟化氫的性質更像水,而不是像其它的鹵化氫,例如HCl。[32][33][34]
HF 液體分子裡的氫鍵使它的黏度變大。氟化氫要到 20 °C 才沸騰,而更重的鹵化氫在 −85 °C 到 −35 °C (−120 °F 到 –30 °F)之間就沸騰了。HF 和水混溶(在任何濃度下都可以溶解),而其它鹵化氫的溶解度有很大差距。氟化氫和水還形成幾種固態化合物,最明顯的是一種1:1的化合物,它直到-40°C(-40°F)才融化。這比純氟化氫的熔點高了44°C[35]。
不像其它氫鹵酸,例如鹽酸,氫氟酸水溶液只是弱酸,酸度係數(pKa) 約為3.19。[36]考慮到HF鍵的極性遠比HCl,HBr或HI中的鍵高,HF在水中的弱酸性是與這個矛盾的。對於這種現象的解釋很複雜,與氫氟酸,水和氟離子的各種簇的形成趨勢以及熱力學問題有關。[note 3]濃度高時,氫氟酸具有自我電離鍵合的特性。HF開始接受氟離子,形成多原子離子(例如氟化氫根,HF−
2)和質子,從而大大提高了它的酸度。[38]在醋酸或類似溶劑中,氫氟酸也是所有氫鹵酸中最強的。[39]它能質子化如鹽酸,硫酸或硝酸的酸,也揭示了其潛在的酸性。[40]儘管氫氟酸是弱酸,它的腐蝕性很強,甚至可以腐蝕玻璃(乾燥的不行)。[38]
干的氟化氫會溶解低價的金屬氟化物。一些分子型氟化物也可溶於 HF。不是氟化物的無機化合物一般會和 HF 反應,而不是溶解。[41]
金屬氟化物
[編輯]金屬氟化物和其它金屬鹵化物不太一樣,有不同的晶體結構。在眾多案例中,金屬氟化物類似金屬氧化物,有相似的成鍵和結構。[42]
由於它的高電負性,氟更趨於形成高氧化態的化合物。很多五氟化物和六氟化物已被發現,而其它五鹵化物和六鹵化物則較少。在室溫下,分子型氟化物可以是固體[43],液體[44]或是氣體[45]。
氟化物的溶解度變化很大,但隨著金屬離子上電荷的增加而趨於降低。氟化物溶液呈鹼性。[46]
| 過渡金屬元素 25–29 的氟化物 | ||||

|

|

|

|

|
| 二氟化錳 | 三氟化鐵 | 氟化鈷 | 氟化鎳 | 氟化銅 |
低氧化態金屬氟化物
[編輯]
鹼金屬形成一氟化物。所有可溶的一氟化物都形成岩鹽結構。[47]一些鹼土金屬氧化物也形成此結構,例如氧化鈣。[48] 由於氟離子是鹼性的,鹼金屬氟化物趨於形成氟化氫鹽,化學式 MHF2。在其它一氟化物中,只有氟化銀[49]和氟化亞鉈[50]被深入了解。它們在水中的溶解度很高,不像其它的鹵化銀/亞鉈一樣難溶。
不像全都可溶於水的一氟化物,有些二氟化物不溶於水。一些過渡金屬二氟化物,如:氟化銅和二氟化鎳是可溶於水的。[49]鹼土金屬形成的二氟化物通常不可溶。[49] 作為比較,鹼土金屬二氯化物都可溶於水。[49]
大部分的二氟化物屬於螢石結構,以螢石(氟化鈣)命名。(這個結構也被很多二氧化物如:CeO2,UO2,ThO2等等形成),其中的金屬離子被8個氟離子包圍。一些二氟化物採用金紅石結構,以二氧化鈦(金紅石)命名,也被其他金屬二氧化物採用。它的結構為四方晶系,金屬原子為八面體配位。
二氟化鈹和其它二氟化物不一樣。鈹的電負性更高,形成的鍵也比其它鹼土金屬氟化物更共價(儘管比起其它鹵化物還是更離子性)。BeF2和SiO2(石英)有很多相似之處,也都形成原子晶體。BeF2具有四面體配位的鈹並形成玻璃(很難結晶)。當它結晶時,氟化鈹具有與石英相同的室溫晶體結構,並且還具有許多在較高溫度出現的結構。
二氟化鈹極易溶於水,[49]而其它鹼土金屬二氟化物不溶於水。(儘管它們有高離子性,它們仍不溶於水,因為螢石結構會形成極強的晶格能。)但是,BeF2在溶液中或熔融時的電導率比離子性時要低得多。[51][52][53][54]
| 二氟化物的晶體或非晶體 | |

|

|
| 螢石結構,是很多二氟化物形成的結構 | 二氟化鈹玻璃的雜亂結構(二維) |
很多金屬可以形成三氟化物,如:鐵、鉍和稀土元素,還有硼族元素和3族元素。大部分稀土元素,還有鉍的三氟化物,都有YF3結構。鈽、釤(高溫下)和鑭的三氟化物則有著LaF3結構。鐵和鎵的三氟化物有著FeF3結構,類似於三氧化錸。只有ScF3在室溫下為立方結構(ReO3),這種材料還具有負熱膨脹的異常特性,這意味著它在相當寬的溫度範圍內受熱時會收縮。

三氟化金採用連結成螺旋狀的–AuF4–正方形連接結構。[55]與金的截然不同的離子型三氟化物相反,它的三氯化物和三溴化物是揮發性的二聚體分子。[56]三氟化鋁是高熔點固體,氣相中是單體,而其它三鹵化物是低熔點的揮發性分子或線形聚合物,氣相時可形成二聚體。[57]沒有一種三氟化物可溶於水,不過一些能溶於其它溶劑。[58]
四氟化物里含有共價鍵和離子鍵。鋯,鉿和許多錒系元素形成四氟化物,其離子結構將金屬陽離子置於8配位的四角反稜柱形分子構型。[59][60]它們的熔點在 1000 °C左右。[61]
四氟化鈦和四氟化錫是多聚體,熔點低於 400 °C。拿對應的氯化物相較,四氯化鈦和四氯化錫在常溫下都是液體。四氟化釩有類似四氟化錫[62]的結構,在100–120 °C 時會歧化成三氟化釩和五氟化釩。
銥、鉑、鈀和銠的四氟化物有一樣的結構,直到1975年才被發現。它們具有八面體配位的金屬原子,共有四個橋接氟原子和兩個未橋接的氟原子。它們的熔點都低於 300 °C。
四氟化錳很不穩定,在常溫下也會分解。[63]只有兩種結構之一: α-MnF4,是被了解的。在該化合物中,錳形成–MnF6–八面體,它們共享橋接的氟原子,形成–Mn4F20–環,然後進一步連接第三維度。[64]
| 一些四氟化物的結構 | ||

|

|

|
| ZrF4,常見的四氟化物結構 | SnF4的多聚體結構 | –Mn4F20– 環,可在 MnF4中找到 |
高氧化態金屬氟化物
[編輯]金屬的五/六氟化物都是分子型的,有些揮發性。釩、鈮和鉭形成五氟化物,也是它們的最高價電中性氟化物。五氟化釩是唯一的非揮發性高電荷金屬氟化物,包含VF6八面體。五氟化鈮和五氟化鉭在結構上具有相同的四面體,不同之處在於它們是四聚體,而不是多聚體。[65]
五氟化鉍是揮發性的,也是一種強氟化劑。在固態下,它是聚合物,由八面體的線性鏈組成,共享軸向氟化物配體。與鹼金屬結合時,五價鉍與氟化物供體反應後可形成六氟鉍酸鹽([BiF6]-),不管是很強(例如NaF[66][67])或不是氟供體(例如XeF4[68])。
很多可以形成六氟化物的元素也可以形成五氟化物。例如鈾可以形成熟知的六氟化鈾,也可以形成五氟化鈾。五氟化鈾的室溫(α)形式具有與五氟化鉍相同的線性鏈結構。UF5的氣態分子具有四方錐結構。
| 五氟化鉍(或alpha-五氟化鈾)的結構 | |
  |
  |
| (XF5)n鏈的結構; X=Bi, U。 | 這些鏈的包裝 |
可以形成六氟化物的金屬包括九個在元素周期表中央的金屬(鉬,鎝,釕,銠,鎢,錸,鋨,銥和鉑)以及元素 92–94:鈾,錼和鈽。在室溫下,六氟化鎢是一種氣體。六氟化鉬和六氟化錸是液體。剩下的金屬六氟化物都是揮發性固體。

金屬六氟化物都是強氧化劑,因為它們都能釋放氟。舉個例子,六氟化鉑是第一個氧化氧氣分子[69]和氙[70]的分子。釙也可以形成六氟化物,但未被深入研究。[71]
錸是唯一一個可以形成七氟化物的金屬。[72]七氟化錸的結構是五角雙錐形分子構型。計算表明可能存在的七氟化銥[73](製備方法被報告[74])、七氟化鎝[75]和七氟化鋨[76]也會有這種結構。
八氟化鋨在1913年被報告,不過在1958年發現它其實是六氟化鋨。[77] 一項 1993 年的理論研究指出八氟化鋨的鍵能很弱,也很難被實驗檢測到。研究預測如果 OsF8成功被合成,它會有兩個不同長度的Os–F鍵。[78]
非金屬氟化物
[編輯]二元非金屬氟化物都是揮發性物質。第2周期元素非金屬氟化物和其它周期元素非金屬氟化物的性質很不同。舉個例子,第2周期元素的氟化物原子從來沒有違背八隅體規則。(硼在元素周期表里的特殊位置使它成為例外。)其它周期的非金屬氟化物可以形成超價分子,例如五氟化磷和六氟化硫。[79]它們的反應性的差別很大,例如六氟化硫是惰性的,而三氟化氯的反應性非常大。
三氟化硼是平面三角形的分子。其中的硼原子只有六顆價電子(不完全八隅體),會接受路易斯鹼並形成加合物。三氟化硼會和路易斯鹼,如:氨或另一個氟離子形成加合物,接受它的電子對來完成八隅體。[80]一氟化硼是一種不穩定的分子,其中有不尋常的硼-氟鍵。(鍵級大於1)這個鍵的鍵級被描述為1.4(單鍵和雙鍵之間)。它和N2是等電子體。[81]

四氟化矽,類似四氟化碳和四氟化鍺,是四面體型結構。[82]SiF4對加熱或電火花穩定,但會與水(甚至潮濕的空氣),金屬和鹼反應,因此顯示出弱酸性,[83]與有機鎂化合物,醇,胺和氨反應,生成加合物。[83]氟矽酸,一種 SiF4的衍生物,是一種只存在於水溶液中的強酸(無水物不存在)。[84]
氮族元素的三氟化物和五氟化物在酸性和反應性有類似的趨勢。NF3對水解穩定,[85]PF3在濕空氣中緩慢水解,[86]而AsF3完全水解。[85]SbF3由於與氟的離子鍵性質增加,因此僅部分水解。它們都是弱路易斯鹼,NF3例外。[85]磷[86]和砷[87]的五氟化物比三氟化物更活潑,五氟化銻則是最強的路易斯酸。[87]氮的五氟化物仍未知,儘管含有+5氧化態的氮四氟銨陽離子 (NF+
4) 是已知的。[88]一氟化氮是在雷射研究中觀察到的亞穩態分子。它和 O2是等電子體。此外,和 BF一樣,一氟化氮的氮-氟鍵的鍵級大於1。[2][89]

氧族元素氟化物也有類似的性質。它們的四氟化物都不穩定,會水解,也會用它們的孤對電子和酸性氟化物形成加合物。硫和硒的四氟化物是分子型的,而 TeF4是一種聚合物。[90]氧族元素六氟化物可以由氧族元素和氟直接反應而成。相比之下,其它的六鹵化物根本不存在。它們的反應性隨著原子序增加而增加:SF6極度惰性,SeF6的反應性略高(例如,在 200 °C (400 °F)下可以和氨反應),而 TeF6可以輕易被水解,形成碲酸。[90]氧的最高價氟化物是二氟化氧,[90]不過氟理論上可以氧化氧到+4價,也就是OF+
3離子。[91] 此外,氧族元素氟化物中還可以有多於一個氧族元素原子 (O2F2、[92]S2F10[93]等等)。
穩定的重鹵素(氯、溴和碘)都可以形成一氟化物、三氟化物和五氟化物: XF,XF3和 XF5。對於七氟化物,只有七氟化碘是已知的。[94]氯和溴的七氟化物還沒被發現,不過去除了一個氟離子形成的ClF+
6和 BrF+
6,都是已知的強氧化劑。[95]砹還沒深入了解,儘管一種叫做一氟化砹的物質被報告,[96]它的存在是有爭議的。[97]大部分氟鹵化物是強氟化劑。值得一提的是三氟化氯,它可以直接氟化石棉和難熔氧化物-甚至可能比五氟化氯具有更高的反應活性。工業上使用的ClF3需要類似氟氣的特殊的預防措施,因為它具有腐蝕性和對人體有害。[98][99]
超強酸
[編輯]一些重要的無機酸含氟。由於氟的強電負性,它們一般很強。氟銻酸(HSbF6),是已知最強的電中性酸。[30]電荷在陰離子上的分散會影響溶劑合質子的酸度(以H
2F+
的形式):這個化合物有極低的 pKa值,為 −28 ,比純硫酸強一京 (1016) 倍。[30]氟銻酸強到可以質子化相對惰性的物質,像是碳氫化合物。匈牙利裔美國化學家喬治·安德魯·歐拉因研究此類反應而獲得了1994年諾貝爾化學獎。[100]
惰性氣體化合物
[編輯]惰性氣體因為價電子層已滿,是非常惰性的物質。直到1960年代,沒有任何惰性氣體化合物被發現。在 1962年,尼爾·巴特利特發現六氟化鉑可以和氙氣反應。他把這種化合物稱為六氟合鉑酸氙,但之後的研究表明其組成並非如此簡單,可能是五氟化鉑酸一氟化氙(II),[XeF]+[PtF5]−,或是十一氟化二鉑酸一氟化氙(II) ,[XeF]+[Pt2F11]−和六氟合鉑酸三氟化二氙,[Xe2F3]+[PtF6]−。[101]尼爾·巴特利特對氙氣的氟化已得到高度讚揚。[102]到了 1962年年底,氙被發現可以直接和氟反應,形成二氟化物和四氟化物。之後,其它惰性氣體化合物也被發現了。

氙的氟化物包括二氟化氙,四氟化氙和六氟化氙。[103]氙還形成各種氟氧化物,例如二氟氧化氙(XeOF2),由四氟化氙的水解而成。[104]其較輕的同系物氪,也可形成特徵明確的化合物,例如二氟化氪。四氟化氪於1963年被報道,[105]但隨後被證明是錯誤的識別;該化合物現在似乎很難合成(儘管氪甚至可能存在六氟化物)。[106]一氟化氪陽離子也被觀測到了[107]。
根據元素周期律,氡會更加活潑。二氟化氡已被獲取。[96]輕惰性氣體(氦到氬)沒有已知的二元氟化物。
元素最高氧化態:氟化物vs氧化物
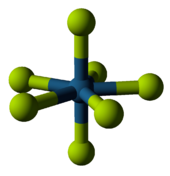
[編輯]| 釕的最高價氟化物和氧化物 | |

|
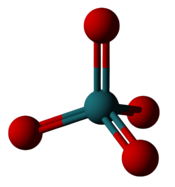
|
| 六氟化釕: 六個氟原子和釕鍵合,不過釕只有 +6 氧化態。 | 四氧化釕:四個氧原子和釕鍵合,形成 +8 氧化態。 |
元素的最高氧化態通常出現在二元氟化物中。一些元素的最高氧化態只在氧化物中出現,另一些則是在氟化物中,還有一些則同時在它們兩者出現。
對於1–5,10,13–16(氮除外)族,它們的氧化物和氟化物的最高氧化態是一樣的。不同之處出現在鉻、7–9族、銅、汞、氮和惰性氣體。氟化允許一些元素達到相對較低[note 4]的最高氧化態,這是其它元素難以得到的。舉個例子,氪目前沒發現任何氧化物,但二氟化氪已得到充分研究。[108]同時,對於非常高氧化態的元素來說,它們的最高氧化態分子通常為氧化物而不是氟化物。例如對於揮發性氧化物(七氧化二物和四氧化物),都沒有對應的七/八氟化物(錸除外)(例如八氟化釕不存在,[109]而四氧化釕已有工業用途。[110])對於元素難以形成七/八氟化物的原因是因為這個原子很難大到可以和這麼多氟原子鍵合,而對應的氧化物所需的氧原子數量只需要一半氟原子數量即可。[111][note 5]不過,八氟化物陰離子,如八氟化碘陰離子(IF−
8),八氟化鋯陰離子(ZrF4−
8)和八氟化氙陰離子(XeF2−
8)是已知的。
最高氧化態的化合物沒有很大的用途,甚至是工業用途。例如,四氟化汞,第一個含有超越+2氧化態的12族元素組成的化合物,打破了5d-殼層,展示了相對論效應對原子的影響,並支持汞、鎘和鋅為過渡金屬。[112]四氟化汞在低溫下存在,在固態氮的溫度下分解。[113]更不穩定的分子還有唯一的鈷(V)分子,CoF+
4陽離子,僅在氣相中觀察到(沒有與其他原子的相互作用,因此在任何化學環境中均未顯示出穩定性)。[109]這種不穩定物種存在的原因很複雜,但可以在假想的NF
5分子的例子上總結如下: 根據現代計算,理論上五個氟原子和一個氮原子可以以不同方式排列,例如NF
3和F
2、NF•
4和F
•、NF
5等等。其中,NF
3+F
2系統的能量最低,最穩定。不過,如果NF
5分子真的被合成,它必須經歷一個高能過渡態,之後才能分解成兩個分子。但是,由於過渡態的能量高於六原子分子,因此需要添加能量以達到過渡態,從而允許五氟化氮分解。該能量稱為活化能。所以,如果只有極低能量(低溫下),這個化合物就可以存在。但是,如何製備五氟化氮是未被解決的問題。[114]
有機氟化合物
[編輯]碳氟鍵是有機化學中最強的鍵。[115]除了分子的低極化率之外,這是促成有機氟化合物的高穩定性的最重要因素。[116]
較小分子的碳氟鍵以三種主要方式形成:氟取代鹵素或氫,或通過雙鍵/三鍵加成。碳氫化合物與氟氣的直接反應可能具有極危險的反應性,因此反應溫度甚至可能需要降低至-150℃(-240 F)。[117]固態氟載體是在加熱時會釋放氟的化合物,尤其是三氟化鈷[118]或氟化氫可以用來氟化。由於氫和氟的范德華半徑類似,經過氟化反應後,分子的大小變化不明顯。[116]當涉及到有機鹵素化合物或不飽和化合物的反應時,或者當需要合成全氟化合物時(通常直接使用電解氟化),直接氟化作用變得不再重要。[119]含氟聚合物是通過聚合自由基形成的。用於烴類聚合物的其他技術不能與用於含氟聚合物。[120]
有機氟化合物的範圍是多種多樣的,反映出有機化學的複雜性。世界存在著大量具有不同氟取代的小分子以及許多聚合物,對特定領域的研究受到應用的商業價值的推動。[121]

|
|
|
|
|

|
|---|---|---|---|---|---|
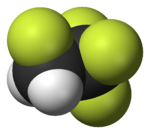
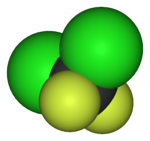
| 氟甲烷(甲基氟),用於半導體製造 | 1,1,1,2-四氟乙烷(R-134a),一種氫氟烴 | 二氟二氯甲烷(R-12 冷凍劑),一種氟氯烴 | 三氟甲磺酸,一種超強酸 | 全氟辛磺酸,一種含氟表面活性劑(圖中顯示了陰離子) | 聚四氟乙烯聚合物的一部分 |
小分子
[編輯]一氟烷烴(一個氫原子被氟取代而成的烷烴)可能在化學和熱力學方面不穩定,但可溶於許多溶劑;但是隨著更多的氟取代氫,穩定性增加,而熔點,沸點以及溶解度降低。當密度和粘度增加時,介電常數,表面張力和折射率都會降低。[122]
部分氟化的烷烴被稱為氫氟烴(HFCs)。如果裡面還有其它鹵素,也可以形成氟氯烴(CFCs)或氟溴烴(BFCs),以及還有保留氫原子的氫氟氯烴(HCFCs)。它們的性質取決於鹵素原子的數量和位置。通常,由於鹵素原子的大小和電荷的變化允許更多的分子間吸引力,因此鹵素原子的組合甚至進一步提高了沸點。[123]類似碳氟化合物,氟氯烴和氟溴烴也不易燃。它們沒有碳-氫鍵發生反應,釋放出的鹵化物使火焰猝滅。[123]

如果所有氫原子都變成氟原子,產生碳氟化合物,一個巨大的區別會因此產生。這些化合物都異常穩定,只有溶於液氨的鈉可以在常溫下攻擊它們。它們也非常難溶,幾乎沒有有機溶劑能夠溶解它們。[122]
不過,如果一種碳氟化合物含有雙鍵/三鍵(全氟烯烴或全氟炔烴),產物會有極高反應性,甚至比對應的碳氫化合物有更高活性。[124]例子:二氟乙炔甚至會在液氮溫度下分解[125]。如果這些分子是不對稱的,那麼有更多氟原子的碳就會被攻擊,因為它帶有 C–F 鍵的正電荷,並且屏蔽性弱[124](這類似於不飽和烴和 HF 反應時的馬氏規則[126])。
全氟化合物,和只由碳和氟組成的碳氟化合物不同,它有其它官能團。[127]它們的性質類似碳氟化合物(惰性、穩定性、不易濕掉、不溶於水和油、滑……)[128],但也會因為其它官能團的存在而產生不同的性質。
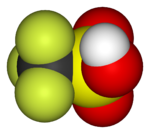
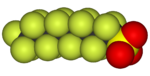
全氟磺酸的酸性很強。甲磺酸的全氟化合物,三氟甲磺酸的酸性足以和高氯酸比較。[129]這些化合物有較低的表面能。因此,全氟辛磺酸已在工業上用作表面活性劑。[129]
聚合物
[編輯]含氟聚合物在許多方面都與對應的小分子相似。將氟添加到聚合物中會以與小分子相同的方式影響性能(增加化學穩定性,熔點,降低可燃性,溶解度等)。但是,每種含氟聚合物都具有自己的特性。[120]
最簡單的含氟塑料是聚四氟乙烯(PTFE,DuPont 品牌名為 Teflon),由結構單元–CF2–組成。PTFE有很長的碳鏈,支鏈都是氟原子。它沒有氫原子,可以看作是聚乙烯(結構單元 –CH2–)的全氟化合物。類似其它碳氟化合物,PTFE有比聚乙烯高的化學和熱穩定性。它對范德華力的抵抗使得 PTFE 是唯一一種壁虎無法粘附的表面。[130]然而,聚四氟乙烯缺乏熔化時轉變的能力,這對於各種 PTFE 衍生物來說不是問題,即FEP(聚全氟乙烯丙烯,一些氟被三氟甲基基團取代)或PFA(聚全氟乙烯甲乙烯醚,一些氟被三氟甲氧基取代)。它們的性質大多類似PTFE,但仍存在差異,即最高使用溫度(非柔性PTFE最高)。[131]
除了聚四氟乙烯,還有很多種氟代塑料。聚偏二氟乙烯(PVDF,結構單元–CF2CH2–),有PTFE的一半氟原子。PVF(聚氟乙烯,結構單元 –CH2CHF–)則有PTFE的四分之一氟原子。[132]PCTFE(聚氯三氟乙烯,結構單元–CF2CFCl–)是另一種重要的化合物。它與PTFE的不同之處在於用氯取代了四分之一的氟,但這種差異帶來了更大的硬度、抗蠕變性和水分持久性。[132]
對聚乙烯氟化並不會使它的氫原子都變成氟原子,只有一層薄層(最多 0.01 mm)會被氟化影響。這有點類似於金屬鈍化。因此,如果只有表面很重要,它們是全氟塑料更便宜的替代品。[133]

Nafion是一種結構複雜的聚合物。它的主鏈類似PTFE,但也含有全氟醚側鏈,並以磺酸基(–SO2OH) 結束。它的化學穩定性很高,確切的性質隨形態而變化。然而,由於化學結構複雜,通過添加陽離子(如 Na+),Nafion會相對容易地轉化為離聚物(顯示導電性)。導電性的原因是由於主碳鏈與側鏈分離,從而形成極性和非極性區域。這種形態極易潮解。[134]
類似其它彈性體(人造橡膠),氟彈性體由三個維度連接的無序聚合物鏈組成。製造氟彈性體的主要挑戰是交聯(與非反應性的聚合物反應),以及去除固化過程中形成的HF。氟彈性體主要有三類:VDF/HFP 是偏二氟乙烯和(至少20%的)六氟丙烯的共聚系統。TFE/丙烯 則是另一種對某些溶劑具有更好耐化學性的共聚系統。TFE/PMVE(全氟甲基乙烯基醚)是一種共聚物系統,可產生全氟代的氟彈性體。[135]
備註
[編輯]- ^ 在這個條目里,類金屬不會從金屬和非金屬分開,而是歸類於更接近的族。舉個例子,鍺被看作是一個金屬,而矽是非金屬。銻在此條目是個非金屬,儘管它的性質更像一個金屬。惰性氣體在這個條目會和其它非金屬隔開,氫是在氟化氫和氫氟酸章節而碳是在有機氟化合物章節里。p區的第7周期元素的氟化合物還沒被研究,就不說它們的氟化合物了。
- ^ 較低的值代表較強的酸性,注意這是對數。
- ^ 參見這篇文章來獲得更多資料。[37]
- ^ 沒有「相對較低」或「相對較高」的界限,它們依賴於元素的性質(並且僅針對最高價氧化物和最高價氟化物處於不同氧化態的元素)。一般來說,+7和+8是高氧化態,而+4或以下是低氧化態。+5和+6則看原子性質,例如原子半徑。對於較小的氮原子,+5是高氧化態,不過對於較大的釕原子和鋨原子,+6仍然是低氧化態。
- ^ 注意這裡所說的是分子型氟化物,而其它類型的極高價氟化物也不太可能存在。這些化合物不可能是完全離子性的,因為原子極高的第六/七/八電離能使反應無法進行(儘管八氟化鋨可能是完全離子性的)[78]。
參考資料
[編輯]- ^ Calderazzo, Fausto. Halide-bridged polymers of divalent metals with donor ligands – Structures and properties. Coordination Chemistry Reviews. 2010, 254 (5–6): 537–554. doi:10.1016/j.ccr.2009.08.007.
- ^ 2.0 2.1 Harbison, G. S. The Electric Dipole Polarity of the Ground and Low-lying Metastable Excited States of NF. Journal of the American Chemical Society. 2002, 124 (3): 366–367. PMID 11792193. doi:10.1021/ja0159261.
- ^ Smart, Bruce E.; Tatlow, J. C. Organofluorine chemistry: Principles and commercial applications. Springer. 1994: 515. ISBN 978-0306446108.
- ^ Riedel, S.; Kaupp, M. The Highest Oxidation States of the Transition Metal Elements (PDF). Coordination Chemistry Reviews. 2009, 253 (5–6): 606–624 [2021-08-11]. doi:10.1016/j.ccr.2008.07.014. (原始內容 (PDF)存檔於2013-06-04).
- ^ Cheng, H.; Fowler, D. E.; Henderson, P. B.; Hobbs, J. P.; Pascaloni, M. R. On the magnetic susceptibility of fluorine. Journal of Physical Chemistry A. 1999, 103 (15): 2861–2866. Bibcode:1999JPCA..103.2861C. doi:10.1021/jp9844720.
- ^ Mackay, Mackay & Henderson 2002,第72頁.
- ^ 7.0 7.1 Greenwood & Earnshaw 1998,第804頁.
- ^ Macomber, Roger S. Organic chemistry 1. University Science Books. 1996: 230 [2011-07-26]. ISBN 978-0-935702-90-3. (原始內容存檔於2021-04-14).
- ^ Hemat, R. A. S. Water 42. Urotext. 2009: 707–709. ISBN 9781903737125.
- ^ 10.0 10.1 Greenwood & Earnshaw 1998,第801頁.
- ^ 11.0 11.1 Akhmetov, N. S. Общая и неорганическая химия [General and inorganic chemistry] 4th. Академик[Akademik]. 2001: 317. ISBN 978-5-06-003363-2 (俄語).
- ^ Bridgeman, Adam J. The Mayer bond order as a tool in inorganic chemistry†. Journal of the Chemical Society, Dalton Transactions. 2001, (14): 2095–2108. doi:10.1039/B102094N.
- ^ Jaccaud et al. 2005,第2頁.
- ^ Nelson, Eugene W. 'Bad man' of the elements. Popular Mechanics. 1947, 88 (2): 106–108, 260 [2021-08-11]. (原始內容存檔於2021-04-14).
- ^ Lidin, Molochko & Andreeva 2000,第442–455頁.
- ^ Greenwood & Earnshaw 1998,第844頁.
- ^ Jaccaud et al. 2005,第3頁.
- ^ Pitzer, Kenneth S. Fluorides of radon and element 118. Journal of the Chemical Society, Chemical Communications. 1975, (18): 760b–761 [2021-08-11]. doi:10.1039/C3975000760B. (原始內容存檔於2021-04-14).
- ^ Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku. A stable argon compound. Nature. 2000, 406 (6798): 874–876. Bibcode:2000Natur.406..874K. PMID 10972285. doi:10.1038/35022551.
- ^ Lidin, Molochko & Andreeva 2000,第252頁.
- ^ Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. Principles of chemistry: The molecular Science. Cengage Learning. 2010: 156 [2011-05-07]. ISBN 978-0-495-39079-4.
- ^ Wiberg, Wiberg & Holleman 2001,第422頁.
- ^ Schlöder, T.; Riedel, S. Investigation of Heterodimeric and Homodimeric Radical Cations of the Series:[F2O2]+,[F2Cl2]+,[Cl2O2]+,[F4]+, and[Cl4]+. RSC Advances. 2012, 2 (3): 876–881. doi:10.1039/C1RA00804H.
- ^ Young, J. P.; Haire, R. G.; Peterson, J. R.; Ensor, D. D.; Fellow, R. L. Chemical consequences of radioactive decay. 2. spectrophotometric study of the ingrowth of berkelium-249 and californium-249 into halides of einsteinium-253. Inorganic Chemistry. 1981, 20 (11): 3979–3983. doi:10.1021/ic50225a076.
- ^ Hulet, E. K. Mendelevium: Divalency and Other Chemical Properties. Science. 1967, 158 (3800): 486–8. Bibcode:1967Sci...158..486H. PMID 17749069. doi:10.1126/science.158.3800.486.
- ^ Kratz, J. V. Critical evaluation of the chemical properties of the transactinide elements (IUPAC Technical Report). Pure and Applied Chemistry. 2003, 75 (1): 103. doi:10.1351/pac200375010103.
- ^ Kahn, Bernd. Radioanalytical chemistry. 2007 [2011-05-04]. ISBN 978-0-387-34122-4. (原始內容存檔於2017-02-28).
- ^ Siegemund et al. 2005,第29頁.
- ^ Acids and bases. askthenerd.com. 2011 [2012-08-18]. (原始內容存檔於2016-03-04).
- ^ 30.0 30.1 30.2 Olah, George A. Crossing conventional boundaries in half a century of research. Journal of Organic Chemistry. 2005, 70 (7): 2413–2429. PMID 15787527. doi:10.1021/jo040285o.
- ^ Hwang, I. C.; Seppelt, K. Gold Pentafluoride: Structure and Fluoride Ion Affinity This work was supported by the Deutsche Forschungsgemeinschaft and the Fond der Chemischen Industrie. Angewandte Chemie International Edition. 2001, 40 (19): 3690–3693. PMID 11592224. doi:10.1002/1521-3773(20011001)40:19<3690::AID-ANIE3690>3.0.CO;2-5.
- ^ Pauling, Linus A. The nature of the chemical bond and the structure of molecules and crystals: An introduction to modern structural chemistry
 . Cornell University Press. 1960: 454–464. ISBN 978-0-8014-0333-0.
. Cornell University Press. 1960: 454–464. ISBN 978-0-8014-0333-0.
- ^ Atkins, Peter; Jones, Loretta. Chemical principles: The quest for insight. W. H. Freeman & Co. 2008: 184–185 [2021-08-11]. ISBN 978-1-4292-0965-6. (原始內容存檔於2021-04-30).
- ^ Emsley, John. The hidden strength of hydrogen. New Scientist. 1981, 91 (1264): 291–292 [2012-12-25]. (原始內容存檔於2021-04-30).
- ^ Greenwood & Earnshaw 1998,第812–816頁.
- ^ Wiberg, Wiberg & Holleman 2001,第425頁.
- ^ Clark, Jim. The acidity of the hydrogen halides. [2011-09-04]. (原始內容存檔於2012-12-24).
- ^ 38.0 38.1 Chambers, C.; Holliday, A. K. Modern inorganic chemistry (An intermediate text) (PDF). The Butterworth Group. 1975: 328–329 [2013-05-03]. (原始內容 (PDF)存檔於2013-03-23).
- ^ Hannan, Henry J. Technician's formulation handbook for industrial and household cleaning Products. Lulu.com. 1975: 31 [2021-08-11]. ISBN 9780615156019. (原始內容存檔於2021-07-23).
- ^ Hannan, Henry J. Course in chemistry for IIT-JEE 2011. Tata McGraw Hill Education Private Limited. 2010: 15–22 [2021-08-11]. ISBN 9780070703360. (原始內容存檔於2021-07-23).
- ^ Greenwood & Earnshaw 1998,第816–819頁.
- ^ Greenwood & Earnshaw 1998,第819頁.
- ^ Lide 2004,第4-76頁.
- ^ Lide 2004,第4-71頁.
- ^ Lide 2004,第4-92頁.
- ^ Oxtoby, David W.; Gillis, H. Pat; Campion, Alan. Principle of Modern Chemistry. Cengage Learning. 2012: 693. ISBN 9780840049315.
- ^ Aigueperse et al. 2005,"Fluorine Compounds, Inorganic," pp. 25–27.
- ^ Arai, Toshihiro. Mesoscopic Materials and Clusters: Their Physical and Chemical Properties. Springer. 1999: 267. ISBN 9783540648840.
- ^ 49.0 49.1 49.2 49.3 49.4 Storer, Frank Humphreys. First Outlines of a Dictionary of Solubilities of Chemical Substances. Cambridge. 1864: 278–80. ISBN 978-1-176-62256-2.
- ^ Remy, Heinrich. Treatise on Inorganic Chemistry: Introduction and main groups of the periodic table. Elsevier Publishing Company. 1956: 383.
- ^ Emeléus & Sharpe 1983,第256–277頁.
- ^ Walsh, Kenneth A. Beryllium chemistry and processing. ASM International. 2009-01-01: 99–102, 118–119 [2021-08-11]. ISBN 978-0-87170-721-5. (原始內容存檔於2021-07-23).
- ^ Mackay, Mackay & Henderson 2002,第243–244頁.
- ^ Hertz, Raymond K. General analytical chemistry of beryllium. Coyle, Francis T. (編). Chemical analysis of metals: a symposium. ASTM. 1987: 74–75 [2021-08-11]. ISBN 978-0-8031-0942-1. (原始內容存檔於2021-07-23).
- ^ F. W. B. Einstein; P. R. Rao; James Trotter; Neil Bartlett. The crystal structure of gold trifluoride. Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1967, 4: 478–482. doi:10.1039/J19670000478.
- ^ Wiberg, Wiberg & Holleman 2001,第1286頁.
- ^ Wiberg, Wiberg & Holleman 2001,第1047頁.
- ^ Sobolev, Boris Petrovich. The Rare Earth Trifluorides: Introduction to materials science of multicomponent metal fluoride crystals. Institut d'Estudis Catalans. 2001: 51. ISBN 978-84-7283-610-5.
- ^ Kern, S.; Hayward, J.; Roberts, S.; Richardson, J. W.; Rotella, F. J.; Soderholm, L.; Cort, B.; Tinkle, M.; West, M.; Hoisington, D.; Lander, G. A. Temperature Variation of the Structural Parameters in Actinide Tetrafluorides. The Journal of Chemical Physics. 1994, 101 (11): 9333–9337 [2021-08-11]. Bibcode:1994JChPh.101.9333K. doi:10.1063/1.467963. (原始內容存檔於2021-04-14).
- ^ Brown, Paul L.; Mompean, Federico J.; Perrone, Jane; Illemassène, Myriam. Chemical Thermodynamics of Zirconium. Gulf Professional Publishing. 2005: 144 [2021-08-11]. ISBN 978-0-444-51803-3. (原始內容存檔於2019-08-11).
- ^ Lide 2004,第4-60, -76, -92, -96頁.
- ^ Becker, S.; Müller, B. G. Vanadium Tetrafluoride. Angewandte Chemie International Edition in English. 1990, 29 (4): 406–407. doi:10.1002/anie.199004061.
- ^ Brown, David; Canterford, J. H.; Colton, Ray. Halides of the Transition Elements: Halides of the first row transition metals, by R. Colton and J. H. Canterford. Wiley. 2009: 213 [2012-06-06]. (原始內容存檔於2021-07-23).
- ^ Nakajimȧ, Tsuyoshi; Žemva, Boris; Tressaud, Alain. Advanced Inorganic Fluorides: Synthesis, Characterization, and Applications
 1st. Elsevier. 2009: 111. ISBN 978-0444720023.
1st. Elsevier. 2009: 111. ISBN 978-0444720023.
- ^ Emeléus & Sharpe 1983,第105頁.
- ^ Breunig, Hans Joachim. Bismuth compounds. Kirk-Othmer Encyclopedia of Chemical Technology Volume 4. John Wiley & Sons. : 22 [2021-08-11]. (原始內容存檔於2013-07-19).
- ^ Wiberg, Wiberg & Holleman 2001,第770頁.
- ^ Suzuki, Hitomi; Matano, Yoshihiro. Organobismuth chemistry
 . Elsevier. 2001: 8. ISBN 978-0-444-20528-5.
. Elsevier. 2001: 8. ISBN 978-0-444-20528-5.
- ^ Bartlett, Neil; Lohmann, D. H. Dioxygenyl hexafluoroplatinate (V), O2+[PtF6]−. Proceedings of the Chemical Society. 1962, (3): 115. doi:10.1039/PS9620000097.
- ^ Bartlett, Neil. Xenon hexafluoroplatinate (V) Xe+[PtF6]−. Proceedings of the Chemical Society. 1962, (6): 218. doi:10.1039/PS9620000197.
- ^ Wiberg, Wiberg & Holleman 2001,第594頁.
- ^ Vogt, T.; Fitch, A. N.; Cockcroft, J. K. Crystal and molecular structures of rhenium heptafluoride. Science. 1994, 263 (5151): 1265–67. Bibcode:1994Sci...263.1265V. PMID 17817431. doi:10.1126/science.263.5151.1265.
- ^ Bayerische Julius-Maximilians-Universität Würzburg 2006,第93頁.
- ^ Technische Universität Berlin. Prediction of new compounds and new oxidation states. 2012 [2012-05-24]. (原始內容存檔於2021-07-24).
- ^ Riedel, S.; Kaupp, M. The highest oxidation states of the transition metal elements. Coordination Chemistry Reviews. 2009, 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014.
- ^ Bayerische Julius-Maximilians-Universität Würzburg 2006,第102頁.
- ^ Weinstock, Bernard; Malm, John G. Osmium Hexafluoride and its Identity with the Previously Reported Octafluoride. Journal of the American Chemical Society. September 1958, 80 (17): 4466–4468. doi:10.1021/ja01550a007.
- ^ 78.0 78.1 Weldkamp, Achim; Frenking, Gernot. Quantum-mechanical ab initio investigation of the transition-metal compounds OsO4, OsO3F2, OsO2F4, OsOF6, and OsF8. Chemische Berichte. 1993, 126 (6): 1325–1330. doi:10.1002/cber.19931260609.
- ^ Noury, Stephane; Silvi, Bernard; Gillespie, Ronald J. Chemical bonding in hypervalent molecules: Is the octet rule relevant? (PDF). Inorganic Chemistry. 2002, 41 (8): 2164–2172 [2012-05-23]. PMID 11952370. doi:10.1021/ic011003v. (原始內容存檔於2020-05-11).
- ^ Greenwood & Earnshaw 1998,第198–199頁.
- ^ Martinie, R. J.; Bultema, J. J.; van der Wal, M. N.; Burkhart, B. J.; van der Griend, D. A.; de Kock, R. L. Bond order and chemical properties of BF, CO, and N2 (PDF). Journal of Chemical Education. 2011, 88 (8): 1094–1097 [2021-08-11]. Bibcode:2011JChEd..88.1094M. doi:10.1021/ed100758t. (原始內容存檔 (PDF)於2017-08-09).
- ^ Ellis, Bryan David. Scientific essentialism. Cambridge University Press. 2001: 69. ISBN 978-0521800945.
- ^ 83.0 83.1 Aigueperse et al. 2005,第28頁.
- ^ Aigueperse et al. 2005,第30頁.
- ^ 85.0 85.1 85.2 Raghavan, P. S. Concepts and problems in inorganic Chemistry. Discovery Publishing House. 1998: 164–165 [2021-08-11]. ISBN 9788171414185. (原始內容存檔於2016-06-17).
- ^ 86.0 86.1 Aigueperse et al. 2005,第37頁.
- ^ 87.0 87.1 Norman, Nicholas C. Chemistry of arsenic, antimony and bismuth. Springer. 1998: 97 [2021-08-11]. ISBN 978-0751403893. (原始內容存檔於2021-07-23).
- ^ Christe, K. O.; Wilson, W. W. Synthesis and characterization of NF+
4BrF−
4 and NF+
4BrF
4O−
. Inorganic Chemistry. 1986, 25 (11): 1904–1906. doi:10.1021/ic00231a038. - ^ Davis, Steven J.; Rawlins, Wilson T.; Piper, Lawrence G. Rate coefficient for the H + NF(a1Δ) reaction (PDF). The Journal of Physical Chemistry. 1989, 93 (3): 1078–1082 [2021-08-11]. doi:10.1021/j100340a013. (原始內容存檔 (PDF)於2021-08-29).
- ^ 90.0 90.1 90.2 Murthy, C. Parameshwara. University chemistry, Tom 1. New Age International. 2008: 180–182, 206–208. ISBN 978-8122407426.
- ^ Crawford, M.; Klapötke, T. M. The trifluorooxonium cation, OF+
3. Journal of Fluorine Chemistry. 1999, 99 (2): 151–156. doi:10.1016/S0022-1139(99)00139-6. - ^ Greenwood & Earnshaw 1998,第639頁.
- ^ Greenwood & Earnshaw 1998,第686頁.
- ^ Wiberg, Wiberg & Holleman 2001,第435頁.
- ^ Wiberg, Wiberg & Holleman 2001,第436頁.
- ^ 96.0 96.1 Pitzer, Kenneth Sanborn (編). Molecular structure and statistical thermodynamics: Selected papers of Kenneth S. Pitzer 1. World Scientific. 1993: 111. ISBN 978-9810214395.
- ^ Gmelin, Leopold. Gmelin handbook of inorganic chemistry: At—Astatine 8th. Springer-Verlag. 1985-07-03: 224. ISBN 9783540935162.
- ^ Greenwood & Earnshaw 1998,第828–830頁.
- ^ Patnaik, Pradyot. A comprehensive guide to the hazardous properties of chemical substances. John Wiley & Sons. 2007: 478–479 [2021-08-11]. ISBN 9780471714583. (原始內容存檔於2016-06-17).
- ^ The Nobel Prize in chemistry 1994. nobelprize.org. [2008-12-22]. (原始內容存檔於2008-08-13).
- ^ Wiberg, Wiberg & Holleman 2001,第392–393頁.
- ^ Chemical and Engineering News as cited by Michael Barnes. Neil Bartlett, emeritus professor of chemistry, dies at 75. University of California Newsroom. [2011-12-24]. (原始內容存檔於2011-10-22).
- ^ Wiberg, Wiberg & Holleman 2001,第438頁.
- ^ Wiberg, Wiberg & Holleman 2001,第400頁.
- ^ Grosse, A. V.; Kirshenbaum, A. D.; Streng, A. G.; Streng, L. V. Krypton Tetrafluoride: Preparation and Some Properties. Science. 1963, 139 (3559): 1047–1048. Bibcode:1963Sci...139.1047G. PMID 17812982. doi:10.1126/science.139.3559.1047.
- ^ Dixon, D. A.; Wang, T. H.; Grant, D. J.; Peterson, K. A.; Christe, K. O.; Schrobilgen, G. J. Heats of Formation of Krypton Fluorides and Stability Predictions for KrF4and KrF6from High Level Electronic Structure Calculations. Inorganic Chemistry. 2007, 46 (23): 10016–10021. PMID 17941630. doi:10.1021/ic701313h.
- ^ Xu, Ruren; Pang, Wenqin; Huo, Qisheng. Main inorganic synthetic chemistry
 . Elsevier. 2010: 54. ISBN 9780444535993.
. Elsevier. 2010: 54. ISBN 9780444535993.
- ^ Wiberg, Wiberg & Holleman 2001,第398頁.
- ^ 109.0 109.1 Riedel, S.; Kaupp, M. The highest oxidation states of the transition metal elements. Coordination Chemistry Reviews. 2009, 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014.
- ^ Technical data sheet 320 Ruthenium tetroxide 0.5% aqueous solution (PDF). Polysciences, Inc: 1. 2000 [2012-12-28]. (原始內容 (PDF)存檔於2011-08-18).
- ^ Bayerische Julius-Maximilians-Universität Würzburg 2006,第34頁.
- ^ Jensen, William B. Is mercury now a transition element?. Journal of Chemical Education. 2008, 85 (9): 1182–1183. Bibcode:2008JChEd..85.1182J. doi:10.1021/ed085p1182
 .
.
- ^ Wang, Xuefang; Andrews, Lester; Riedel, Sebastian; Kaupp, Martin. Mercury is a transition metal: The first experimental evidence for HgF4. Angewandte Chemie. 2007, 119 (44): 8523–8527. doi:10.1002/ange.200703710.
- ^ Lewars 2008,第60–61頁.
- ^ O'Hagan, D. Understanding organofluorine chemistry. An introduction to the C–F bond. Chemical Society Reviews. 2008, 37 (2): 308–319. PMID 18197347. doi:10.1039/b711844a.
- ^ 116.0 116.1 Siegemund et al. 2005,第2頁.
- ^ Siegemund et al. 2005,第4頁.
- ^ Jaccaud et al. 2005,第13頁.
- ^ Siegemund et al. 2005,第3–5頁.
- ^ 120.0 120.1 Carlson & Scmiegel 2005,第3頁.
- ^ Okazoe, Takashi. Overview on the history of organofluorine chemistry from the viewpoint of material industry (PDF). Proceedings of the Japan Academy, Series B. 2009, 85 (8): 276–289 [2021-08-11]. Bibcode:2009PJAB...85..276O. PMC 3621566
 . PMID 19838009. doi:10.2183/pjab.85.276. (原始內容存檔於2021-05-05).
. PMID 19838009. doi:10.2183/pjab.85.276. (原始內容存檔於2021-05-05).
- ^ 122.0 122.1 Siegemund et al. 2005,第7–8頁.
- ^ 123.0 123.1 Sukornick, B. Potentially acceptable substitutes for the chlorofluorocarbons. International Journal of Thermophysics. 1989, 10 (3): 553–561. Bibcode:1989IJT....10..553S. doi:10.1007/BF00507978.
- ^ 124.0 124.1 Siegemund et al. 2005,第18頁.
- ^ Urben, Peter. Bretherick's Handbook of Reactive Chemical Hazards 7th. Surendra Kumar. 2006: 269. ISBN 9780123725639.
- ^ Siegemund et al. 2005,第5頁.
- ^ Mendicino, L. Environmental issues in the electronics and semiconductor industries. The Electrochemical Society. 1999: 116. ISBN 9781566772303.
- ^ Knepper, Thomas P.; Lange, Frank T. Polyfluorinated Chemicals and Transformation Products
 . Springer. 2011: 27. ISBN 9783642218712.
. Springer. 2011: 27. ISBN 9783642218712.
- ^ 129.0 129.1 Siegemund et al. 2005,第32頁.
- ^ University of California, Berkeley. Research into gecko adhesion. [2011-04-29]. (原始內容存檔於2007-10-14).
- ^ Carlson & Scmiegel 2005,第3–4頁.
- ^ 132.0 132.1 Carlson & Scmiegel 2005,第4頁.
- ^ Kharitonov, A. P.; Taege, R.; Ferrier, G.; Piven, N. P. The kinetics and mechanism of the direct fluorination of polyethylenes (PDF). Surface Coatings International Part B: Coatings Transactions. 2005, 88 (3): 201–212 [2013-05-03]. doi:10.1007/BF02699574. (原始內容 (PDF)存檔於2013-05-15).
- ^ Rhoades, David Walter. Broadband dielectric spectroscopy studies of Nafion. 2008: 2. ISBN 9780549785408.
- ^ Martin, John Wilson. Concise encyclopedia of the structure of materials. Elsevier. 2007: 187–194 [2021-08-11]. ISBN 978-0-08-045127-5. (原始內容存檔於2016-06-17).
擴展閱讀
[編輯]- Bayerische Julius-Maximilians-Universität Würzburg. The Highest Oxidation States of the 5d Transition Metals: a Quantum-Chemical Study (PDF) (報告). Chemical Society. 2006 [2011-06-20]. (原始內容存檔 (PDF)於2013-03-23).
- Emeléus, H. J.; Sharpe, A. G. Advances in Inorganic Chemistry and Radiochemistry 27th. Academic Press. 1983 [2021-08-11]. ISBN 978-0-12-023627-5. (原始內容存檔於2021-07-23).
- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Butterworth Heinemann. 1998. ISBN 978-0-7506-3365-9.
- Lewars, Errol G. Modeling marvels: Computational anticipation of novel molecules. Springer. 2008 [2021-08-11]. ISBN 978-1-4020-6972-7. (原始內容存檔於2021-04-14).
- Lide, David R. Handbook of Chemistry and Physics
 84th. CRC Press. 2004. ISBN 978-0-8493-0566-5.
84th. CRC Press. 2004. ISBN 978-0-8493-0566-5. - Lidin, P. A.; Molochko, V. A.; Andreeva, L. L. Химические свойства неорганических веществ [Chemical properties of inorganic substances]. Khimiya. 2000. ISBN 978-5-7245-1163-6 (俄語).
- Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. Introduction to modern inorganic chemistry 6th. CRC Press. 2002. ISBN 978-0-7487-6420-4.
- Ullmann, Franz (編). Encyclopedia of Industrial Chemistry. Wiley-VCH. 2005. ISBN 978-3-527-30673-2.
- Aigueperse, Jean; Mollard, Paul; Devilliers, Didier; Chemla, Marius; Faron, Robert; Romano, Renée; Cuer, Jean Pierre. Fluorine Compounds, Inorganic. Ullmann's Encyclopedia of Industrial Chemistry. 2000. ISBN 978-3-527-30673-2. doi:10.1002/14356007.
- Carlson, D. Peter; Scmiegel, Walter. Fluoropolymers, Organic. Ullmann's Encyclopedia of Industrial Chemistry. 2000. ISBN 978-3527306732. doi:10.1002/14356007.a11_393.
- Jaccaud, Michael; Faron, Robert; Devilliers, Didier; Romano, René. Fluorine. Ullmann's Encyclopedia of Industrial Chemistry. 2000. ISBN 978-3527306732. doi:10.1002/14356007.a11_293.
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick. Inorganic chemistry. Academic Press. 2001 [2011-03-03]. ISBN 978-0-12-352651-9. (原始內容存檔於2020-03-21).
- Yaws, Carl L.; Braker, William. Fluorine. Matheson Gas Data Book, Book 2001. McGraw-Hill Professional. 2001. ISBN 978-0-07-135854-5.
