芳香烴
芳香
此外,在芳香族中,一些芳香環中並不完全是苯的結構,而是其中的碳原子,會被氮、氧、硫等元素取代,我們稱之為雜環,例如:像是呋喃的五元環中,包括一個氧原子,吡咯中含有一個氮原子,噻吩含有一個硫原子等。
而芳烴可分為:
而具有鏈狀的芳香烴一般稱之為脂芳烴(arenes),常見的脂芳烴有甲苯、乙苯、苯乙烯等。
苯環模型
[編輯]
苯,為最簡單的一種芳香烴,芳香族化合物皆由其衍生而成,首先在1865年,由弗里德里希·凱庫勒年提出了苯環單鍵、雙鍵交替排列、無限共軛的結構,即現在所謂「凱庫勒式」。又提出了苯中的雙鍵並不是固定的,而是會藉由共振,產生介於單鍵與雙鍵之間的鍵長,以圓圈型的符號表示代表苯中電子的未定域化。苯結構是一個平面正六邊形分子,碳原子以sp2軌域鍵結,所以任二鍵互成120°。
性質
[編輯]芳香烴具有下列性質,一般稱之為芳香性(aromaticity):
- 具有特別的穩定性,通常每個雙鍵氫化熱為28~30仟卡,預估環己三烯的氫化熱為85.8仟卡,但實際上該化合物(即苯)的氫化熱只有49.8仟卡,低了預估值36仟卡,這個值稱為苯的共振能(resonance energy),穩定了整個化合物。
- 苯的核磁共振光譜(NMR)出現在7.3ppm,比一般烯類的氫原子還要處於低磁場(down field),這是因為苯的電子環可產生誘導磁場(induced magnetic field),使的質子所需的感應磁場較弱,這種往低磁場方向移動的特性可用來檢驗一化合物是否具有芳香性。
- 由苯的分子式C6H6,看起來應屬於不飽和烴,但比較它與環己烯的性質後就會發現截然不同,苯中看似擁有雙鍵,應具有不飽和烴活性大的性質,但由於π電子的共振結合,卻異常安定,故反應性通常比烯類還小。下表比較苯與環己烯的性質:
| 試劑 | 環己烯 | 苯 |
|---|---|---|
| KMnO4
(冷、稀溶液) |
迅速氧化 | 無反應 |
| Br2/CCl4
(黑暗中) |
迅速加成 | 無反應 |
| HI | 迅速加成 | 無反應 |
| H2+Ni | 迅速氫化
(25度C,20 lb/in2) |
緩慢氫化
(100~200度C,1500 lb/in2) |
德國化學家Hückel根據量子力學計算,若環狀電子要具備芳香性,共振電子數必須為4n+2個(n=0,1,2,...),ex:苯環有六個共振電子,符合Hückel規則故為芳香族;環庚三烯基陽離子(cycloheptatrienyl cation)有六個π電子,所以具備穩定的芳香性;;環庚三烯基陰離子(cycloheptatrienyl anion)有八個π電子,故較不穩定。
芳香烴反應
[編輯]取代反應
[編輯]這是芳香烴的有機反應中最常見的反應,可分為親電芳香取代反應和親核芳香取代反應,通常是其中的氫原子被其他物質所取代。
親電芳香取代反應
[編輯]
親電芳香取代反應(electrophilic aromatic substitution),為親電試劑與芳香環所進行的取代反應,該反應類型主要可分為硝化反應、鹵代反應、磺化反應以及傅-克反應。反應機構中有一個中間物,而他會進行共振,這個中間物有個特別的名稱,一般稱之為σ-錯合物或者芳基正離子(arenium ion),整個反應為環當親核基攻擊親電試劑,產生σ-錯合物,再用鹼抓住並脫去質子,完成取代反應。
親核取代反應
[編輯]親核芳香取代反應,為親核劑與芳香環所進行的取代反應,該反應類型主要可分為加成-消去與消去-加成二種。加成-消去主要依循SNAr反應機構,而不是遵循過去常見的SN1以及SN2反應機構,過程中亦會產生一會共振的中間物,但這個中間物所帶的是負電荷,所以我們不叫他sigma錯合物而稱之為Meisenheimer錯合物。消去-加成反應則是在反應過程中形成一種名為苯炔的中間物,再利用親核基攻擊苯炔,完成取代反應。是利用同位素標定法確定其反應機構,並用狄爾斯-阿爾德反應的捕捉技巧,確認這個反應性很強的中間物存在。
顯色反應
[編輯]芳烴和一些試劑作用,可以產生特徵顏色,用於鑑別不同種類的芳烴:
| 名稱 | 結構式 | 在無水三氯化鋁的存在下 與氯仿反應顯色[1] |
在四氯化碳溶液中 和五氯化銻反應顯色[2] |
和甲醛-硫酸試劑作用顯色[3] (Le Rosen 試驗) |
|---|---|---|---|---|
| 苯 | 橙色至紅色 (苯及同系物) |
黃色 | 紅色 | |
| 甲苯 | 黃橙色(硝基苯溶劑)[2] | 紅色 | ||
| 乙苯 | 紅褐色 | |||
| 正丁苯 | 紅色[4] | |||
| 均三甲苯 | 黃褐色 | |||
| 六甲基苯 | 暗紅色(硝基苯溶劑)[2] | |||
| 六乙基苯 | 黃色 | |||
| 1,3,5-三苯基苯 | 藍色 | |||
| 苯甲醚 | 紅紫色 | |||
| 苯甲醛 | 紅色 黃棕色(濃硫酸中) | |||
| 二苯基乙烯 | 棕色 | |||
| 芳基鹵化物 | 橙色至紅色 | 粉紅色至紫紅色[4] | ||
| 沒食子酸 | 黃綠色 | |||
| 苯酚 | 紅紫色 | |||
| 對苯二酚 | 黑色 | |||
| 萘 | 藍色或紫色 (萘及衍生物) |
綠色 | ||
| 聯苯 | 紫色 | 藍綠色 | ||
| 聯苄 | 暗紅色 | |||
| 三聯苯 | 藍色或綠藍色[4] | |||
| 二苯甲烷 | 紅色 | |||
| 菲 | 紫色 | |||
| 蒽 | 綠色[5] | 綠色沉澱 | 黃綠色 | |
| 芴 | 綠色 | |||
| 咔唑 | 綠色 |
反應機理:
- 3 C6H6 + CHCl3 —AlCl3→ Ph3CH + 3 HCl
- Ph3CH + AlCl3 → Ph3C+AlCl4-
- ArH + SbCl5 → ArH*+ + SbCl5*-
- 2 SbCl5*- → SbCl4- + SbCl6-
- 2 C6H6 + CH2O → Ph-CH2-Ph + H2O
- Ph-CH2-Ph + 2 H2SO4 → Ph-CH=C6H4=O + 3 H2O + 2 SO2
多環芳香烴
[編輯]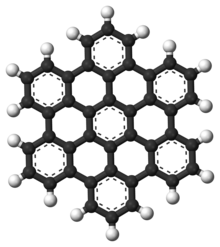
多環芳香烴(PAHs)是由芳香環結合而成且不含有雜原子和取代基的芳香烴。[6]萘是最簡單的多環芳香烴之一。多環芳香烴存在於油、煤炭和焦油中,是燃料(無論是化石燃料還是生物質)燃燒的副產品。多環芳香烴作為污染物,它們受到關切,因為一些化合物被確認會致癌、導致變異或引起發展缺陷。多環芳香烴也出現於食物中。根據研究,高溫烹飪的肉(如燒烤)和熏魚中含有大量多環芳香烴。[7][8][9]
它們也存在於星際物質、彗星和隕石中,可能是形成最早生命形式的主要物質。在石墨烯中,多環芳香烴被擴大成大型平面結構。
苯及其衍生物
[編輯]- 苯及其衍生物
參考文獻
[編輯]- ^ John C. Gilbert., Stephen F. Martin. Experimental Organic Chemistry: A Miniscale and Microscale Approach[永久失效連結]. Brooks/Cole CENGAGE Learning, 2011. pp 872. 25.10 Aromatic Hydrocarbons and Aryl Halides - Classification test - Chloroform and Aluminum Chloride. ISBN 978-1-4390-4914-3
- ^ 2.0 2.1 2.2 V. Gold. Advances in Physical Organic Chemistry. Vol 13. Academic Press, 1976. pp 164. ISBN 0-12-033513-1
- ^ Fritz Feigl. Spot Tests in Organic Analysis, Elsevier, 1966. ISBN 0-444-40209-8
- ^ 4.0 4.1 4.2 姚瑾. 介紹一個鑑別烷烴與芳烴的簡易方法. 化學教學 , 1991 (1) :48-48
- ^ http://www.chem.umass.edu/people/mcdaniel/CHEM-268/Experiments/Qualitative-Organic-Analysis.pdf (頁面存檔備份,存於網際網路檔案館) pp 778
- ^ Fetzer, J. C. The Chemistry and Analysis of the Large Polycyclic Aromatic Hydrocarbons. Polycyclic Aromatic Compounds (New York: Wiley). 2000, 27 (2): 143. ISBN 0-471-36354-5. doi:10.1080/10406630701268255.
- ^ Polycyclic Aromatic Hydrocarbons – Occurrence in foods, dietary exposure and health effects (PDF). European Commission, Scientific Committee on Food. December 4, 2002 [2021-12-24]. (原始內容存檔 (PDF)於2011-05-19).
- ^ Larsson, B. K.; Sahlberg, GP; Eriksson, AT; Busk, LA. Polycyclic aromatic hydrocarbons in grilled food. J. Agric. Food Chem. 1983, 31 (4): 867–873. PMID 6352775. doi:10.1021/jf00118a049.
- ^ Polycyclic Aromatic Hydrocarbons (PAHs). Agency for Toxic Substances and Disease Registry. 1996 [2021-12-24]. (原始內容存檔於2021-02-08).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||
| ||||||